题目内容
9.下列溶液中有关微粒的物质的量浓度关系正确的是( )| A. | NaHSO3和NaHCO3的中性混合溶液中(S和C均用R表示):c(Na+)=c(HRO3-)+2c(RO32-) | |
| B. | 等体积等物质的量浓度的NaCl和NaClO溶液中离子总数:N前<N后 | |
| C. | 1mol/L的(NH4)2Fe(SO4)2•6H2O溶液中:c(NH4+)=c(SO42-)>c(Fe2+)>c(H+) | |
| D. | 0.1mol/LNaHX溶液pH=3,则此溶液中有:c(HX-)>c(H2X)>c(X2-) |
分析 A.混合溶液呈中性,说明c(H+)=c(OH-),溶液中存在电荷守恒,根据电荷守恒判断;
B.NaClO能发生水解反应生成HClO和OH-,氢离子浓度小于10-7mol/L,所以NaCl溶液中c(Na+)+c(H+)大于NaClO溶液中c(Na+)+c(H+);
C.NH4+、Fe2+相互抑制水解,SO42-不水解,但NH4+、Fe2+的水解程度都较小;
D.0.1mol/L的NaHX溶液pH=3>7,溶液呈酸性,说明HX-电离程度大于水解程度.
解答 解:A.混合溶液呈中性,说明c(H+)=c(OH-),溶液中存在电荷守恒,根据电荷守恒得c(Na+)=c(HRO3-)+2c(RO32-),故A正确;
B.HClO是弱酸,所以NaClO溶液中发生水解反应:ClO-+H2O?HClO+OH-,使溶液呈碱性,氢离子浓度小于10-7mol/L,所以NaCl溶液中c(Na+)+c(H+)大于NaClO溶液中c(Na+)+c(H+),根据电荷守恒:c(Na+)+c(H+)=c(OH-)+c(Cl-)可得溶液中离子总数为2×[c(Na+)+c(H+)]×V;同理可得NaClO溶液中总数为2×[c(Na+)+c(H+)]×V,所以NaCl溶液中离子总数大于NaClO溶液,故B错误;
C.NH4+、Fe2+相互抑制水解,SO42-不水解,但NH4+、Fe2+的水解程度都较小,所以c(SO42-)>c(NH4+)>c(Fe2+)>c(H+),故C错误;
D.0.1mol/L的NaHX溶液pH=3>7,溶液呈酸性,说明HX-电离程度大于水解程度,但其水解和电离程度都较小,所以离子浓度大小顺序是:c(HX-)>c(X2-)>c(H2X),故D错误;
故选A.
点评 本题考查离子浓度大小比较,为高频考点,明确溶液中溶质性质是解本题关键,知道离子电离或水解程度相对大小,注意B中离子等量代换,易错选项是AB.

 字词句段篇系列答案
字词句段篇系列答案| A. | 加入水时,溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$增大 | |
| B. | 降低温度,溶液中c(NH4+)增大 | |
| C. | 加入少量NaOH固体,平衡向左移动,电离平衡常数减小 | |
| D. | 加入少量0.1 mol•L-1 盐酸,溶液中c(OH-)增大 |
| A. | Al2S3 | B. | FeCl2 | C. | Fe(OH)3 | D. | H2SiO3 |
| A. | NH4+、NO3-、Al3+、Cl- | B. | K+、SO42-、HCO3-、Na+ | ||
| C. | Mg2+、NO3-、OH-、Na+ | D. | MnO4-、K+、SO42-、Na+ |
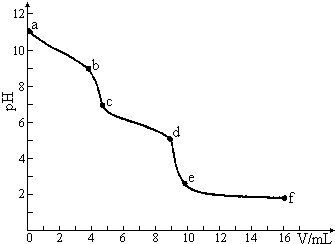 常温下,用已知浓度的盐酸滴定未知浓度的Na2CO3溶液.用 pH传感器测得混合溶液的pH变化曲线如下图(已知:饱和CO2溶液的pH为5.6),下列说法正确的是 ( )
常温下,用已知浓度的盐酸滴定未知浓度的Na2CO3溶液.用 pH传感器测得混合溶液的pH变化曲线如下图(已知:饱和CO2溶液的pH为5.6),下列说法正确的是 ( )| A. | 该Na2CO3溶液的浓度为0.001mol/L | |
| B. | 在pH=7时,c(Na+)=c(Cl-) | |
| C. | 在pH=6时,c(Na+)>c(HCO3-)>c(CO32-) | |
| D. | c→d发生的主要离子反应为:CO32-+H+=HCO3- |
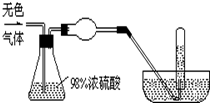 有一无色气体(可能由O2、N2、CO2、HCl、NH3、H2、NO、NO2中的一种或几种组成),体积为100mL.如图示通过浓硫酸的洗气瓶,发现气体体积减少到一半;通过球形干燥管后气体呈红棕色,再将该气体完全通入盛满水且倒立于水槽的试管内,发现倒立于水槽的试管内的水位下降后又缓慢上升,最后试管内全部充满液体,由此判断:
有一无色气体(可能由O2、N2、CO2、HCl、NH3、H2、NO、NO2中的一种或几种组成),体积为100mL.如图示通过浓硫酸的洗气瓶,发现气体体积减少到一半;通过球形干燥管后气体呈红棕色,再将该气体完全通入盛满水且倒立于水槽的试管内,发现倒立于水槽的试管内的水位下降后又缓慢上升,最后试管内全部充满液体,由此判断: