题目内容
17.下列说法不正确的是( )| A. | Cl2能使湿润的有色布条褪色,所以Cl2具有漂白性 | |
| B. | 红热的铁丝在Cl2中剧烈燃烧,反应生成FeCl3 | |
| C. | 利用溴单质的氧化性可以把碘离子转化为碘单质 | |
| D. | 实验室常用NaOH溶液吸收多余的Cl2以避免污染 |
分析 A.氯气和水反应生成盐酸和次氯酸,次氯酸具有漂白作用;
B.氯气具有强氧化性氧化变价金属为高价态化合物;
C.溴单质氧化性大于碘单质,氧化剂的氧化性大于氧化产物;
D.氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水;
解答 解:A.氯气和水反应生成盐酸和次氯酸,次氯酸具有漂白作用,氯气无漂白作用,故A错误;
B.氯气具有强氧化性氧化变价金属为高价态化合物,红热的铁丝在Cl2中剧烈燃烧,反应生成FeCl3,故B正确;
C.溴单质氧化性大于碘单质,溴单质氧化碘离子生成碘单质,故C正确;
D.氯气有毒不能排放到空气中,需要用氢氧化钠溶液吸收,故D正确;
故选A.
点评 本题考查了了氯气、溴单质等物质性质,主要是错误的判断,掌握基础是解题关键,题目较简单.

练习册系列答案
相关题目
7.下列各组离子在指定溶液中可能大最共存的是( )
| A. | 能使石蕊试液变红色的溶液中:Na+、CO32-、K+、ClO-、I- | |
| B. | 能与金属铝反应放出H2的溶液中:K+、NO3-、Cl-、NH4+ | |
| C. | 常温下水电离出的c(H+)•c(OH-)=10-20mol/L的溶液中:Na+、Cl-、S2-、SO32- | |
| D. | 中性溶液:K+、HCO3-、NO3-、SO42-、Fe3+ |
8.硫代硫酸钠溶液与稀硫酸的反应为Na2S2O3+H2SO4═Na2SO4+SO2↑+S↓+H2O,某兴趣小组以该反应为例探究反应速率的影响因素并设计了如下实验,下列说法不正确的是( )
| 实验 序号 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
| V/mL | c/mol•L-1 | V/mL | c/mol•L-1 | V/mL | ||
| 1 | 25 | 5 | 0.1 | 10 | 0.1 | 5 |
| 2 | 25 | 5 | 0.2 | 5 | 0.2 | 10 |
| 3 | 35 | 5 | 0.1 | 10 | 0.1 | 5 |
| A. | 实验1和实验2可以探究Na2S2O3浓度对反应速率的影响 | |
| B. | 实验1和实验3可以探究温度对反应速率的影响 | |
| C. | 通过测定单位时间内收集到气体的体积判断化学反应速率快慢 | |
| D. | 实验3时,应先分别将Na2S2O3溶液、H2SO4溶液和水置于热水浴中加热到所需温度再混合发生反应,记录反应所需时间 |
5.下列物质中属于盐的是( )
| A. | MgO | B. | H2SO4 | C. | NaOH | D. | KNO3 |
12.下列关于硫酸铜溶液和氢氧化铁胶体的说法中,正确的是( )
| A. | 前者是混合物,后者是纯净物 | |
| B. | 两者都具有丁达尔效应 | |
| C. | 分散质的粒子直径均在1~100nm之间 | |
| D. | 前者可用于杀菌,后者可用于净水 |
2.下列离子方程式正确的是( )
| A. | 将氯气通入水中:Cl2+H2O?2H++Cl-+ClO- | |
| B. | 碳酸钙溶于醋酸:CaCO3+2H+═Ca2++CO2↑+H2O | |
| C. | 铁与FeCl3溶液反应:Fe+Fe3+═2Fe2+ | |
| D. | 硫酸溶液与氯化钡溶液混合:Ba2++SO42-═BaSO4↓ |
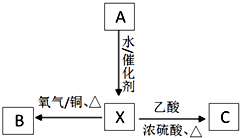 A为标准状况下密度为1.25g•L-1的常见气态烃.有关物质的转化关系如图:请回答:
A为标准状况下密度为1.25g•L-1的常见气态烃.有关物质的转化关系如图:请回答: