题目内容
化学反应可为人类提供能量
(Ⅰ)家用液化气的主要成分之一是丁烷(C4H10),常温常压下,当5.8kg丁烷完全燃烧并生成二氧化碳和液态水时,放出热量为2.9×105kJ,试写出丁烷燃烧的热化学方程式: ,已知1mol液态水气化时需要吸收44kJ的热量,则反应:
C4H10(g)+
O2(g)=4CO2(g)+5H2O(g)的△H为 .
(Ⅱ)铅蓄电池是化学电源,其电极材料分别是Pb和PbO2,电解质溶液为稀硫酸.工作时,该电池的总反应为
PbO2+Pb+2H2SO4=2PbSO4+2H2O,根据上述情况判断:
(1)蓄电池的负极是 ,其电极反应式为 .
(2)蓄电池的正极电极反应式为 .
(3)蓄电池工作时,其中电解质溶液的pH (填“增大”、“减小”或“不变”).
(Ⅰ)家用液化气的主要成分之一是丁烷(C4H10),常温常压下,当5.8kg丁烷完全燃烧并生成二氧化碳和液态水时,放出热量为2.9×105kJ,试写出丁烷燃烧的热化学方程式:
C4H10(g)+
| 13 |
| 2 |
(Ⅱ)铅蓄电池是化学电源,其电极材料分别是Pb和PbO2,电解质溶液为稀硫酸.工作时,该电池的总反应为
PbO2+Pb+2H2SO4=2PbSO4+2H2O,根据上述情况判断:
(1)蓄电池的负极是
(2)蓄电池的正极电极反应式为
(3)蓄电池工作时,其中电解质溶液的pH
考点:热化学方程式,化学电源新型电池
专题:化学反应中的能量变化,电化学专题
分析:(Ⅰ)依据质量换算物质的量,结合化学方程式对应的物质的量计算反应放出的热量,依据热化学方程式书写方法,标注物质聚集状态和反应焓变写出;
已知1mol液态水汽化时需要吸收44kJ热量,依据热化学方程式和盖斯定律计算得到;
(Ⅱ)(1)原电池中失电子的一极为负极,蓄电池的负极上Pb失电子生成硫酸铅;
(2)根据电极反应中得到电子发生还原反应的为正极;
(3)根据电池总反应判断溶液的PH变化.
已知1mol液态水汽化时需要吸收44kJ热量,依据热化学方程式和盖斯定律计算得到;
(Ⅱ)(1)原电池中失电子的一极为负极,蓄电池的负极上Pb失电子生成硫酸铅;
(2)根据电极反应中得到电子发生还原反应的为正极;
(3)根据电池总反应判断溶液的PH变化.
解答:
解:当5.8kg丁烷完全反应物质的量
=100mol,完全燃烧并生成二氧化碳和液态水时,放出热量为2.9×105kJ,2mol丁烷完全反应放热=
=5800KJ,依据反应物和产物状态标注聚集状态和对应量下的反应热,书写的热化学方程式为:2C4H10(g)+13O2(g)=8CO2(g)+10H2O(l)△H=-5800kJ/mol,已知1mol液态水汽化时需要吸收44kJ热量,①H2O(l)=H2O(g)△H=44KJ/mol;②2C4H10(g)+13O2(g)=8CO2(g)+10H2O(l)△H=-5800kJ/mol;
依据盖斯定律①×10+②得到2C4H10(g)+13O2(g)=8CO2(g)+10H2O(g)△H=-5360kJ/mol,则得到反应,C4H10(g)+
O2(g)═4CO2(g)+5H2O(g)△H=-2680KJ/mol;
故答案为:2C4H10(g)+13O2(g)=8CO2(g)+10H2O(l)△H=-5800kJ/mol;-2680KJ/mol;
(Ⅱ)(1)原电池中失电子的一极为负极,则蓄电池的负极是Pb,蓄电池的负极上Pb失电子生成硫酸铅,其电极反应方程式为:Pb-2e-+SO42-=PbSO4;
故答案为:Pb;Pb-2e-+SO42-=PbSO4;
(2)已知蓄电池的正极反应方程式为:PbO2+2e-+4H++SO42-=PbSO4+2H2O;
故答案为:PbO2+2e-+4H++SO42-=PbSO4+2H2O;
(3)已知该电池的总反应为PbO2+Pb+2H2SO4=2PbSO4+2H2O,反应中消耗硫酸,所以反应后溶液的PH增大,
故答案为:增大.
| 5800g |
| 58g/mol |
| 2.9×105KJ |
| 50 |
依据盖斯定律①×10+②得到2C4H10(g)+13O2(g)=8CO2(g)+10H2O(g)△H=-5360kJ/mol,则得到反应,C4H10(g)+
| 13 |
| 2 |
故答案为:2C4H10(g)+13O2(g)=8CO2(g)+10H2O(l)△H=-5800kJ/mol;-2680KJ/mol;
(Ⅱ)(1)原电池中失电子的一极为负极,则蓄电池的负极是Pb,蓄电池的负极上Pb失电子生成硫酸铅,其电极反应方程式为:Pb-2e-+SO42-=PbSO4;
故答案为:Pb;Pb-2e-+SO42-=PbSO4;
(2)已知蓄电池的正极反应方程式为:PbO2+2e-+4H++SO42-=PbSO4+2H2O;
故答案为:PbO2+2e-+4H++SO42-=PbSO4+2H2O;
(3)已知该电池的总反应为PbO2+Pb+2H2SO4=2PbSO4+2H2O,反应中消耗硫酸,所以反应后溶液的PH增大,
故答案为:增大.
点评:本题考查了热化学方程式的书写方法和计算应用,题目较简单,注意焓变计算和物质聚集状态的标注.

练习册系列答案
相关题目
下列有关热化学方程式的叙述正确的是( )
| A、含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为: NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l);△H=-57.4kJ?mol-1 |
| B、已知C(石墨,s)=C(金刚石,s);△H>0,则石墨比金刚石稳定 |
| C、已知反应2H2(g)+O2(g)=2H2O(l);△H=-571.6kJ?mol-1,则H2的燃烧热为285.8kJ?mol-1 |
| D、已知2C(s)+2O2(g)=2CO2(g)△H1;2C(s)+O2(g)=2CO(g)△H2,则△H1>△H2 |
某蓄电池放电、充电时反应为:Fe+Ni2O3+3H2O
Fe(OH)2+2Ni(OH)2,下列推断不正确的是( )
| 放电 |
| 充电 |
| A、放电时,负极上的电极反应式是:Fe+2OH--2e-=Fe(OH)2 |
| B、放电时,每转移2 mol 电子,正极上有1 mol Ni2O3被氧化 |
| C、充电时,阳极上的电极反应式是:2Ni(OH)2-2e-+2OH-=Ni2O3+3H2O |
| D、该蓄电池的电极必须是浸在某种碱性电解质溶液中 |
 已知可逆反应aA+bBcC中,物质的含量A%和C%随温度的变化曲线如图所示,下列说法正确的是 (两个答案)( )
已知可逆反应aA+bBcC中,物质的含量A%和C%随温度的变化曲线如图所示,下列说法正确的是 (两个答案)( )| A、该反应在T1、T3温度时达到过化学平衡 |
| B、该反应在T2温度时达到过化学平衡 |
| C、该反应的逆反应是吸热反应 |
| D、升高温度,平衡会向正反应方向移动 |
下列判断错误的是( )
| A、NO2可与水反应 |
| B、Al(OH)3是既能与强酸反应又能与强碱反应,是两性氢氧化物 |
| C、金属钠投入硫酸铜溶液中可置换出金属铜 |
| D、NaHCO3俗称是小苏打,可用作食用碱 |
常温下,向20mL pH=11的氨水中加水稀释,下列说法正确的是( )
A、溶液中c(NH3?H2O)?
| ||||
| B、NH3?H2O的电离程度增大,c(OH-)也增大 | ||||
| C、溶液中导电微粒数目减少 | ||||
| D、再加20mL pH=3的盐酸,混合溶液的pH=7 |
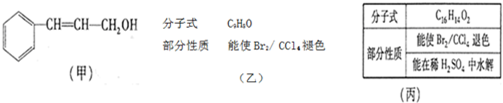
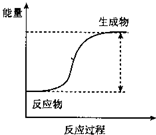 (1)反应的分类研究:从能量变化角度分,将反应分为放热反应和吸热反应.下列反应中能量变化符合如图所示的是
(1)反应的分类研究:从能量变化角度分,将反应分为放热反应和吸热反应.下列反应中能量变化符合如图所示的是