题目内容
现有36g的铜铝合金与足量的质量分数为40%、密度为1.2g/cm3的NaOH溶液反应,产生33.6升(标准状况)氢气.求
(1)NaOH溶液的物质的量浓度?
(2)合金中铜的质量分数?
(1)NaOH溶液的物质的量浓度?
(2)合金中铜的质量分数?
考点:化学方程式的有关计算
专题:计算题
分析:(1)设氢氧化钠溶液的体积为VL,先根据m=ρV、n=
计算出氢氧化钠的物质的量,再根据c=
计算出NaOH溶液物质的量浓度;
(2)根据Al与氢氧化钠反应方程式由氢气的物质的量求出Al的物质的量和质量,再求出Cu的质量分数.
| m |
| M |
| n |
| V |
(2)根据Al与氢氧化钠反应方程式由氢气的物质的量求出Al的物质的量和质量,再求出Cu的质量分数.
解答:
解:(1)质量分数为40%、密度为1.2g/cm3的NaOH溶液,
设氢氧化钠溶液的体积为VL,
则m=ρV=1.2g/cm3×V×103ml×40%=4.8V×102g,则n=
=12Vmol,所以c=
=12mol/L;
答:NaOH溶液的物质的量浓度为12mol/L;
(2)现有36g的铜铝合金与足量的氢氧化钠反应生成33.6升(标准状况)氢气,则n(H2)=
=
=1.5mol,
2Al+2OH-+2H2O=2AlO2-+3H2↑;
2mol 3mol
1mol 1.5mol,
则Al的物质的量为1mol,即27g,则Cu的质量分数为
×100%=25%;
答:合金中铜的质量分数为25%.
设氢氧化钠溶液的体积为VL,
则m=ρV=1.2g/cm3×V×103ml×40%=4.8V×102g,则n=
| m |
| M |
| n |
| V |
答:NaOH溶液的物质的量浓度为12mol/L;
(2)现有36g的铜铝合金与足量的氢氧化钠反应生成33.6升(标准状况)氢气,则n(H2)=
| V |
| Vm |
| 33.6L |
| 22.4L/mol |
2Al+2OH-+2H2O=2AlO2-+3H2↑;
2mol 3mol
1mol 1.5mol,
则Al的物质的量为1mol,即27g,则Cu的质量分数为
| 36-27 |
| 36 |
答:合金中铜的质量分数为25%.
点评:本题考查了物质的量浓度的计算、有关方程式的计算等,题目难度不大,注意掌握物质的量的概念及简单计算方法,明确物质的量与其它物理量之间的转化关系,试题培养了学生灵活应用所学知识的能力.

练习册系列答案
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案
相关题目
浓盐酸和氯酸钾的反应如下:KClO3+6HCl→KCl+3Cl2+3H2O其中发生氧化反应的氯原子和发生还原反应的氯原子的质量比是( )
| A、1:6 | B、1:5 |
| C、5:1 | D、6:1 |
某工厂利用FeCl3溶液腐蚀镀有铜的绝缘板生产电路板,一实验小组对该厂生产电路后所得的废液进行分析.取50.0 mL废液,向其中加入0.64 g Cu,金属铜全部溶解.另取50.0 mL废液,向其中加入足量的AgNO3,析出沉淀43.05 g,下列说法正确的是( )
| A、原废液中含有的金属阳离子只有Fe2+和Cu2+ |
| B、该工厂原来使用的FeCl3溶液的物质的量浓度约为2 mol/L |
| C、若向500 mL废液中加入足量的稀HNO3溶液,在标况下产生NO气体4.48 L,则原废液中Fe2+和Cu2+的物质的量浓度之比为2:1 |
| D、可以使用硫氰化钾溶液检验该废液中是否含有Fe2+ |
下列离子方程式书写正确的是( )
| A、氯化亚铁溶液中通入氯气:Fe2++Cl2═Fe3++2C1- |
| B、金属钠投入水中Na+H2O═Na++OH-+H2↑ |
| C、铝粉投入到NaOH溶液中:2Al+2OH-═2AlO2-+H2↑ |
| D、氯化铁溶液中加氨水3NH3?H2O+Fe3+=3NH4++Fe(OH)3↓ |
在下述反应中,浓H2SO4既表出现氧化性,又表现出酸性的是( )
| A、C+2H2SO4(浓)=CO2↑+2SO2↑+2H2O |
| B、Fe2O3+3H2SO4=Fe2(SO4)3+3H2O |
| C、Na2CO3+H2SO4=Na2SO4+CO2↑+H2O |
| D、Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2O |
下列关于“摩尔”的说法正确的是( )
| A、摩尔是一个物理量 |
| B、摩尔是表示物质数量的单位 |
| C、摩尔表示物质的数量的量 |
| D、摩尔是物质的量的单位 |
在密闭容器中发生可逆反应aA(g)+bB(g)?pC(g)△H<0,平衡时测得A的浓度为0.5mol/L保持温度不变,将容器的容积缩小到原来的一半,再达平衡时测得A的浓度为1.2mol/L下列有关判断正确的是( )
| A、C的体积分数下降 |
| B、a+b>p |
| C、正反应速率和逆反应速率均减小,平衡向逆反应方向移动 |
| D、正反应速率和逆反应速率均加大,平衡向正反应方向移动 |
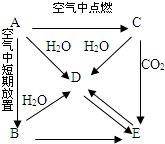 有A、B、C、D、E五种物质都含同一种元素,C为一种淡黄色的固体.它们按下图所示的关系相互转化,已知A为单质.按要求回答问题.
有A、B、C、D、E五种物质都含同一种元素,C为一种淡黄色的固体.它们按下图所示的关系相互转化,已知A为单质.按要求回答问题.