题目内容
已知室温下,向浓度均为0.1mol?L-1的HCl、NH4Cl、AlCl3混合溶液中,逐滴加入NaOH溶液.下列示意图表示生成Al(OH)3的物质的量与加入NaOH溶液的体积的关系,合理的是( )
A、 |
B、 |
C、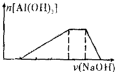 |
D、 |
考点:化学方程式的有关计算,镁、铝的重要化合物
专题:图示题
分析:假设HCl、NH4Cl、AlCl3的物质的量均为1mol,首先发生反应:HCl+NaOH=NaCl+H2O,消耗NaOH为1mol,再发生反应:AlCl3+3NaOH=Al(OH)3↓+3NaCl,消耗NaOH为3mol,然后发生反应:NH4Cl+NaOH=NH3.H2O+NaCl,消耗1mol NaOH,最后发生反应:Al(OH)3+NaOH=NaAlO2+H2O,消耗1mol NaOH,据此解答.
解答:
解:假设HCl、NH4Cl、AlCl3的物质的量均为1mol,首先发生反应:HCl+NaOH=NaCl+H2O,消耗NaOH为1mol,再发生反应:AlCl3+3NaOH=Al(OH)3↓+3NaCl,消耗NaOH为3mol,然后发生反应:NH4Cl+NaOH=NH3.H2O+NaCl,消耗1mol NaOH,最后发生反应:Al(OH)3+NaOH=NaAlO2+H2O,消耗1mol NaOH,
A.由上述分析可知,NaOH首先与HCl反应,此时无沉淀产生,故A错误;
B.由上述分析可知,沉淀量达到最大值时,NaOH与氯化铵反应后,再与氢氧化铝沉淀反应,故B错误;
C.图象符合反应过程,且各阶段消耗氢氧化钠之比为1:3:1:1,符合实际,故C正确;
D.由上述分析可知,NaOH首先与HCl反应,此时无沉淀产生,故D错误,
故选C.
A.由上述分析可知,NaOH首先与HCl反应,此时无沉淀产生,故A错误;
B.由上述分析可知,沉淀量达到最大值时,NaOH与氯化铵反应后,再与氢氧化铝沉淀反应,故B错误;
C.图象符合反应过程,且各阶段消耗氢氧化钠之比为1:3:1:1,符合实际,故C正确;
D.由上述分析可知,NaOH首先与HCl反应,此时无沉淀产生,故D错误,
故选C.
点评:本题考查化学反应图象及化学方程式计算,难度中等,明确反应的先后顺序是关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
Se是人体必需微量元素,下列关于7834Se和8034Se的说法正确的是( )
| A、7834Se和8034Se互为同位素 |
| B、7834Se和8034Se都含有34个中子 |
| C、7834Se和8034Se分别含有44和46个质子 |
| D、7834Se和8034Se含有不同的电子数 |
 已知Ba[Al(OH)4]可溶于水.如图表示的是向Al2(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量(x)的关系.下列有关叙述正确的是( )
已知Ba[Al(OH)4]可溶于水.如图表示的是向Al2(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量(x)的关系.下列有关叙述正确的是( )| A、a~b时沉淀的物质的量:Al(OH)3比BaSO4多 |
| B、c~d时溶液中离子的物质的量:[Al(OH)4]-比Ba2+多 |
| C、a~d时沉淀的物质的量:BaSO4可能小于Al(OH)3 |
| D、d~e时溶液中离子的物质的量:Ba2+一定等于OH- |
下列燃料中,热值最高的是( )
| A、石油 | B、煤 | C、天然气 | D、乙醇 |
 把由NaOH、AlCl3、MgCl2三种固体组成的混合物溶于足量水后有0.58g白色沉淀生成.在所得悬浊液中逐滴加入0.5mol?L-1的盐酸,加入盐酸的体积与生成沉淀的质量关系如图所示:
把由NaOH、AlCl3、MgCl2三种固体组成的混合物溶于足量水后有0.58g白色沉淀生成.在所得悬浊液中逐滴加入0.5mol?L-1的盐酸,加入盐酸的体积与生成沉淀的质量关系如图所示: 三种短周期A、B、C在元素周期表中的位置如图所示.已知A、B、C 三种元素的原子最外层电子数之和为12.据此填空:
三种短周期A、B、C在元素周期表中的位置如图所示.已知A、B、C 三种元素的原子最外层电子数之和为12.据此填空: