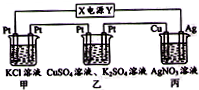
题目内容
 把由NaOH、AlCl3、MgCl2三种固体组成的混合物溶于足量水后有0.58g白色沉淀生成.在所得悬浊液中逐滴加入0.5mol?L-1的盐酸,加入盐酸的体积与生成沉淀的质量关系如图所示:
把由NaOH、AlCl3、MgCl2三种固体组成的混合物溶于足量水后有0.58g白色沉淀生成.在所得悬浊液中逐滴加入0.5mol?L-1的盐酸,加入盐酸的体积与生成沉淀的质量关系如图所示:(1)混合物中NaOH、AlCl3、MgCl2的质量分别是多少?
(2)C点所表示的盐酸的体积是多少?
考点:离子方程式的有关计算
专题:计算题
分析:(1)由生成沉淀的质量关系图可知,滴加的前10mL稀盐酸,没有影响沉淀的量,说明滴加的稀盐酸在与混合物中剩余的氢氧化钠发生反应;继续滴加稀盐酸时,沉淀量增加,此时稀盐酸与NaAlO2发生反应产生Al(OH)3沉淀;此后再滴加的稀盐酸与氢氧化铝和氢氧化镁的沉淀发生反应,直至Mg(OH)2和Al(OH)3沉淀全部溶解;
综合以上分析,混合物中的氢氧化钠溶于水后与氯化镁、氯化铝发生反应后还有剩余,剩余的氢氧化钠与稀盐酸发生反应;固体物中的氯化铝与氢氧化钠反应生成NaAlO2;因此,计算出的质量就可以根据反应的化学方程式计算氯化铝的质量;
(2)P点为全部反应完全反应后所消耗稀盐酸的量,需要计算出氢氧化铝、氢氧化镁两种沉淀物完全溶解所消耗稀盐酸的量.
综合以上分析,混合物中的氢氧化钠溶于水后与氯化镁、氯化铝发生反应后还有剩余,剩余的氢氧化钠与稀盐酸发生反应;固体物中的氯化铝与氢氧化钠反应生成NaAlO2;因此,计算出的质量就可以根据反应的化学方程式计算氯化铝的质量;
(2)P点为全部反应完全反应后所消耗稀盐酸的量,需要计算出氢氧化铝、氢氧化镁两种沉淀物完全溶解所消耗稀盐酸的量.
解答:
解:(1)从图中可以看出,Mg(OH)2的质量为0.58 g,即0.01 mol,根据反应:MgCl2+2NaOH═2NaCl+Mg(OH)2↓,
m(MgCl2)=0.01 mol×95 g?mol-1=0.95 g,n1(NaOH)=2n[Mg(OH)2]=0.02 mol.
开始至加入10 mL盐酸,发生反应:NaOH+HCl═NaCl+H2O,
n2(NaOH)=n(HCl)=0.5 mol?L-1×10×10-3L=5×10-3 mol.
盐酸的加入量从10~30 mL 发生反应:NaAlO2+HCl+H2O═Al(OH)3↓+NaCl,
n(NaAlO2)=n(HCl)=0.5 mol?L-1×(30-10)×10-3L=0.01 mol.
根据反应:AlCl3+4NaOH═NaAlO2+3NaCl+2H2O
n3(NaOH)=4n(NaAlO2)=0.04 mol,
m(AlCl3)=0.01 mol×133.5 g?mol-1=1.335 g,
m(NaOH)=(0.02 mol+5×10-3mol+0.04 mol)×40 g?mol-1=2.6 g.
答:混合物中NaOH、AlCl3、MgCl2的质量分别是2.6g、1.335g、0.95g;
(2)根据反应:Al(OH)3+3HCl═AlCl3+3H2O,
Mg(OH)2+2HCl═MgCl2+2H2O
n(HCl)=0.01 mol×3+0.01 mol×2=0.05 mol
V(HCl)=
=0.1L
C点加入盐酸的体积为30mL+100mL=130mL.
答:C点所表示的盐酸的体积是130mL.
m(MgCl2)=0.01 mol×95 g?mol-1=0.95 g,n1(NaOH)=2n[Mg(OH)2]=0.02 mol.
开始至加入10 mL盐酸,发生反应:NaOH+HCl═NaCl+H2O,
n2(NaOH)=n(HCl)=0.5 mol?L-1×10×10-3L=5×10-3 mol.
盐酸的加入量从10~30 mL 发生反应:NaAlO2+HCl+H2O═Al(OH)3↓+NaCl,
n(NaAlO2)=n(HCl)=0.5 mol?L-1×(30-10)×10-3L=0.01 mol.
根据反应:AlCl3+4NaOH═NaAlO2+3NaCl+2H2O
n3(NaOH)=4n(NaAlO2)=0.04 mol,
m(AlCl3)=0.01 mol×133.5 g?mol-1=1.335 g,
m(NaOH)=(0.02 mol+5×10-3mol+0.04 mol)×40 g?mol-1=2.6 g.
答:混合物中NaOH、AlCl3、MgCl2的质量分别是2.6g、1.335g、0.95g;
(2)根据反应:Al(OH)3+3HCl═AlCl3+3H2O,
Mg(OH)2+2HCl═MgCl2+2H2O
n(HCl)=0.01 mol×3+0.01 mol×2=0.05 mol
V(HCl)=
| 0.05mol |
| 0.5mol/L |
C点加入盐酸的体积为30mL+100mL=130mL.
答:C点所表示的盐酸的体积是130mL.
点评:根据滴加稀盐酸与产生沉淀的关系图,分析各阶段所发生的反应,利用各阶段反应的化学方程式进行相关物质质量的计算;本题所涉及的反应比较复杂,在分析时逐个反应梳理清楚是解决本问题的关键.

练习册系列答案
相关题目
下列叙述正确的是( )
| A、蛋白质、人造纤维和光导纤维都属于有机高分子化合物 |
| B、化学反应的过程可以看做是储存在物质内部的能量转化为热、电、光能等释放出来或者是热、电、光能等转化为物质内部的能量被储存起来的过程 |
| C、共价键是原子问通过共用电子对形成的,离子键是阴、阳离子问通过静电吸引力形成的 |
| D、合金材料都是由两种或两种以上金属元素组成的 |
一定体积0.01mol/L的稀硝酸溶液恰好能氧化一定质量的铁、铝混合物,已知两种金属均被氧化为最高价态,还原产物只有NO.若用0.01mol/L NaOH溶液溶解相同质量的该混合物,当反应完全时所需氢氧化钠溶液的体积是稀硝酸溶液的1/5,则样品中铁、铝的物质的量之比为( )
| A、1:4 | B、1:3 |
| C、2:3 | D、5:3 |
某K2SO4样品中含有Na2SO4、KNO3和Ba(NO3)2三种杂质中的一种或两种.现称取17.4g样品于烧杯中加入足量水溶解,充分搅拌后得到澄清溶液.再往此澄清溶液加入过量的BaCl2溶液得到20g沉淀.对样品所含的杂质判断正确的是( )
| A、杂质一定不含KNO3 |
| B、杂质一定含有Ba(NO3)2可能还含有KNO3 |
| C、杂质一定不含Na2SO4 |
| D、杂质一定含KNO3可能还含有Na2SO4 |
下列叙述正确的是( )
| A、电解饱和食盐水制烧碱采用离子交换膜法,可以阻止阳离子通过 |
| B、在铁上镀锌时,锌棒作阴极,且电解液硫酸锌的浓度是不变的 |
| C、用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1:2 |
| D、用惰性电极电解饱和NaCl溶液,若有1mol电子转移,则生成1mol NaOH |
已知室温下,向浓度均为0.1mol?L-1的HCl、NH4Cl、AlCl3混合溶液中,逐滴加入NaOH溶液.下列示意图表示生成Al(OH)3的物质的量与加入NaOH溶液的体积的关系,合理的是( )
A、 |
B、 |
C、 |
D、 |
有关下列两种溶液的说法中,正确的是( )①0.1mol?L-1 CH3COONa溶液 ②0.1mol?L-1 CH3COOH溶液.
| A、相同温度下,溶液中水的电离程度:溶液①>溶液② | ||
| B、等体积混合溶液①和溶液②,所得溶液中c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | ||
C、加水稀释溶液①,溶液中
| ||
D、向溶液①中加少量的CH3COONa固体则
|