题目内容
一定质量的甲烷和CO的混合气体完全燃烧后得到CO2、水蒸气,总质量为204g,当其缓慢经过无水CaCl2充分吸收水分后,CaCl2增重72g.求原混合气体中甲烷和CO的物质的量.
考点:有关混合物反应的计算
专题:计算题
分析:无水氯化钙吸收的为水,据此可知甲烷燃烧生成水的质量,根据二氧化碳、水的总质量为204g可以计算出二氧化碳的质量,然后根据n=
计算出水、二氧化碳的物质的量,最后分别根据H、C原子守恒计算出混合气体中甲烷、CO的物质的量.
| m |
| M |
解答:
解:无水氯化钙吸收的为水蒸气,即甲烷完全燃烧生成水的质量为72g,水的物质的量为:n(H2O)=
=4mol,
根据H元素守恒可知,甲烷的物质的量为:n(CH4)=
=
=2mol,
甲烷与CO的混合气体完全燃烧生成二氧化碳的质量为:204g-72g=132g,二氧化碳的物质的量为:n(CO2)=
=3mol,
根据碳原子守恒,CO的物质的量为:n(CO)=n(CO2)-n(CH4)=3mol-2mol=1mol,
即:原混合气体中含有2mol甲烷、1molCO,
答:原混合气体中含有甲烷、CO的物质的量分别为:2mol、1mol.
| 72g |
| 18g/mol |
根据H元素守恒可知,甲烷的物质的量为:n(CH4)=
| n(H2O)×2 |
| 4 |
| 4mol×2 |
| 4 |
甲烷与CO的混合气体完全燃烧生成二氧化碳的质量为:204g-72g=132g,二氧化碳的物质的量为:n(CO2)=
| 132g |
| 44g/mol |
根据碳原子守恒,CO的物质的量为:n(CO)=n(CO2)-n(CH4)=3mol-2mol=1mol,
即:原混合气体中含有2mol甲烷、1molCO,
答:原混合气体中含有甲烷、CO的物质的量分别为:2mol、1mol.
点评:本题考查了混合物燃烧的计算,题目难度不大,正确分析题干信息为解答本题的关键,注意质量守恒在化学计算中的应用,试题培养了学生的分析、理解能力及化学计算能力.

练习册系列答案
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案
相关题目
下列属于第三周期的元素的是( )
| A、Li | B、Al | C、F | D、He |
某K2SO4样品中含有Na2SO4、KNO3和Ba(NO3)2三种杂质中的一种或两种.现称取17.4g样品于烧杯中加入足量水溶解,充分搅拌后得到澄清溶液.再往此澄清溶液加入过量的BaCl2溶液得到20g沉淀.对样品所含的杂质判断正确的是( )
| A、杂质一定不含KNO3 |
| B、杂质一定含有Ba(NO3)2可能还含有KNO3 |
| C、杂质一定不含Na2SO4 |
| D、杂质一定含KNO3可能还含有Na2SO4 |
下列叙述正确的是( )
| A、电解饱和食盐水制烧碱采用离子交换膜法,可以阻止阳离子通过 |
| B、在铁上镀锌时,锌棒作阴极,且电解液硫酸锌的浓度是不变的 |
| C、用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1:2 |
| D、用惰性电极电解饱和NaCl溶液,若有1mol电子转移,则生成1mol NaOH |
化学中的平衡:如化学平衡、溶解平衡、电离平衡.下列不存在平衡的是(不考虑水的电离平衡)( )
| A、稀醋酸溶液中 |
| B、氢氧化钙悬浊液中 |
| C、二氧化硫与氧气反应的混合物中 |
| D、稀氯化钠水溶液中 |
已知室温下,向浓度均为0.1mol?L-1的HCl、NH4Cl、AlCl3混合溶液中,逐滴加入NaOH溶液.下列示意图表示生成Al(OH)3的物质的量与加入NaOH溶液的体积的关系,合理的是( )
A、 |
B、 |
C、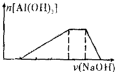 |
D、 |
通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.则下列热化学方程式不正确的是( )
| 化学键 | A-A | B-B | A-B |
| 生成1mol化学键时放出的能量 | 436kJ?mol-1 | 243kJ?mol-1 | 431kJ?mol-1 |
A、
| ||||
| B、A2(g)+B2(g)═2AB(g)△H=-183kJ?mol-1 | ||||
C、
| ||||
| D、2AB(g)═A2(g)+B2(g))△H=+183kJ?mol-1 |
 SiH4(硅烷)法生产高纯多晶硅是非常优异的方法.
SiH4(硅烷)法生产高纯多晶硅是非常优异的方法.