题目内容
配平下列氧化还原方程式:
(1) KMnO4+ HCl(浓)═ KCl+ MnCl2+ Cl2+ H2O
(2) KMnO4+ KNO2+ ═ MnSO4+ K2SO4+ KNO3+ H2O.
(1)
(2)
考点:氧化还原反应方程式的配平
专题:氧化还原反应专题
分析:(1)反应中KMnO4→MnCl2,Mn元素化合价由+7降低为+2,共降低5价,Cl(浓)→Cl2,Cl元素化合价由-1价升高为0价,共升高为2价,化合价升降最小公倍数为10,故KMnO4的系数为2,Cl2的系数为5,再根据原子守恒配平其它物质的系数;
(2)根据质量守恒定律判断未知的反应物为硫酸,反应中KMnO4→MnSO4,Mn元素化合价由+7降低为+2,共降低5价;KNO2中N元素化合价从+3升高到硝酸钾中+5价,化合价升高2价,根据化合价升降相等配平该反应的方程式.
(2)根据质量守恒定律判断未知的反应物为硫酸,反应中KMnO4→MnSO4,Mn元素化合价由+7降低为+2,共降低5价;KNO2中N元素化合价从+3升高到硝酸钾中+5价,化合价升高2价,根据化合价升降相等配平该反应的方程式.
解答:
解:(1)反应中KMnO4+→MnCl2,Mn元素化合价由+7降低为+2,共降低5价,Cl(浓)→Cl2,Cl元素化合价由-1价升高为0价,共升高为2价,化合价升降最小公倍数为10,故KMnO4的系数为2,Cl2的系数为5,再根据原子守恒配平其它物质的系数,配平后的方程式为:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O,
故答案为:2;16;2;2;5;8;
(2)反应后中含有H元素和硫酸根离子,则未知反应物为H2SO4;反应中KMnO4→MnSO4,Mn元素化合价由+7降低为+2,共降低5价;KNO2中N元素化合价从+3升高到硝酸钾中+5价,化合价升高2价,化合价变化的最小公倍数为10,则高锰酸钾的系数为2,KNO2的系数为5,再根据质量守恒定律配平其它物质,配平后的方程式为:2KMnO4+5KNO2+3H2SO4═2MnSO4+K2SO4+5KNO3+3H2O,
故答案为:2;5;3H2S04;2;1;5;3.
故答案为:2;16;2;2;5;8;
(2)反应后中含有H元素和硫酸根离子,则未知反应物为H2SO4;反应中KMnO4→MnSO4,Mn元素化合价由+7降低为+2,共降低5价;KNO2中N元素化合价从+3升高到硝酸钾中+5价,化合价升高2价,化合价变化的最小公倍数为10,则高锰酸钾的系数为2,KNO2的系数为5,再根据质量守恒定律配平其它物质,配平后的方程式为:2KMnO4+5KNO2+3H2SO4═2MnSO4+K2SO4+5KNO3+3H2O,
故答案为:2;5;3H2S04;2;1;5;3.
点评:本题考查氧化还原反应,为高频考点,题目难度中等,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念的考查,注意从元素化合价角度分析.

练习册系列答案
相关题目
下列关于胶体的说法正确的是( )
| A、胶体与其他分散系的本质区别是粒子直径的大小 |
| B、Fe(OH)3胶体能产生丁达尔效应 |
| C、明矾净水是利用胶体的吸附性 |
| D、雾、豆浆、淀粉溶液属于胶体 |
设NA为阿伏加德罗常数的值.下列叙述正确的是( )
| A、常温下,17.6g丙烷中所含的极性共价键为4NA |
| B、常温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA |
| C、常温下,将5.6g铁投入到足量浓硝酸中,反应转移的电子数目为0.3NA |
| D、12 g金刚石中含有的共价键数为4 NA |
下列物质属于纯净物的是( )
| A、苯 | B、聚乙烯 | C、汽油 | D、煤 |
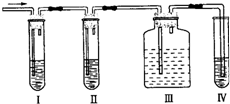 某混合气体可能是乙烯和二氧化硫的混合气,有人设计下列实验图以确认上述混合气体中有CH2=CH2和SO2.Ⅰ、Ⅱ、Ⅲ、Ⅳ装置中盛放的试剂依次是:品红溶液、NaOH溶液、品红溶液、酸性KMnO4溶液.回答下列问题:
某混合气体可能是乙烯和二氧化硫的混合气,有人设计下列实验图以确认上述混合气体中有CH2=CH2和SO2.Ⅰ、Ⅱ、Ⅲ、Ⅳ装置中盛放的试剂依次是:品红溶液、NaOH溶液、品红溶液、酸性KMnO4溶液.回答下列问题: