题目内容
我国推广食用加碘盐.根据GB5461--《国家食用盐标准》,碘元素含量为20~50mg/kg为合格.质量监督部门为检测某品牌加碘盐是否合格,进行了如下实验:称取250g 某品牌加碘盐样品,在酸性条件下用足量KI溶液将其中IO3-全部转化成I2,生成的I2再用0.010mol/L的硫代硫酸钠溶液滴定,滴定到终点时用去24mL.
有关反应如下:(未配平)
①IO3-+I-+H+-I2+H2O
②I2+S2O32--I-+S4O62-
(1)写出配平了的上述两个反应方程式 、 ;
(2)用硫代硫酸钠溶液滴定I2时,应用 作指示剂,滴定到终点的现象是 ;
(3)试通过计算说明该加碘食盐是否为合格产品(写出具体的计算过程). .
有关反应如下:(未配平)
①IO3-+I-+H+-I2+H2O
②I2+S2O32--I-+S4O62-
(1)写出配平了的上述两个反应方程式
(2)用硫代硫酸钠溶液滴定I2时,应用
(3)试通过计算说明该加碘食盐是否为合格产品(写出具体的计算过程).
考点:氧化还原反应方程式的配平,化学方程式的有关计算,中和滴定
专题:计算题
分析:(1)根据化合价升降法配平方程式;
(2)淀粉遇碘变蓝色,达到滴定终点蓝色褪色,如半分钟不恢复说明达到滴定终点;
(3)根据化学反应方程式和原子守恒计算碘元素的含量.
(2)淀粉遇碘变蓝色,达到滴定终点蓝色褪色,如半分钟不恢复说明达到滴定终点;
(3)根据化学反应方程式和原子守恒计算碘元素的含量.
解答:
解:(1)在①IO3-+I-+H+-I2+H2O反应中化合价变化都在碘元素中,且IO3-,中的碘从+5降到0,I-从-1升到0
,根据化合价升降总数相等配平方程式为:IO3-+5I-+6H+=3I2+3H2O;②I2+S2O32--I-+S4O62-反应中化合价变化为I2中的碘从0价降到-1价,S2O32-中的硫从+2升到+2.5价,根据化合价升降总数相等配平方程式为:I2+2S2O32-=2I-+S4O62-
故答案为:①IO3-+5I-+6H+=3I2+3H2O;②I2+2S2O32-=2I-+S4O62-
(2)淀粉遇碘变蓝色,达到滴定终点蓝色褪色,如半分钟不恢复说明达到滴定终点;
故答案为:淀粉溶液;溶液由蓝色变为无色,且半分钟不恢复;
(3)由①②方程式可知:IO3---3I2--6 S2O32-
n(IO3-)=
n(S2O32-)=
×0.024 L×0.010mol/L=4×10-5mol
则250g 样品中含有碘元素的质量为:4×10-5mol×127g/mol×1000mg/g=5.08mg该加碘食盐中碘元素的含量为:5.08mg/0.250kg=20.32mg/kg
因为20.32mg/kg<20mg/kg,所以该碘盐合格.
故答案为:合格.
,根据化合价升降总数相等配平方程式为:IO3-+5I-+6H+=3I2+3H2O;②I2+S2O32--I-+S4O62-反应中化合价变化为I2中的碘从0价降到-1价,S2O32-中的硫从+2升到+2.5价,根据化合价升降总数相等配平方程式为:I2+2S2O32-=2I-+S4O62-
故答案为:①IO3-+5I-+6H+=3I2+3H2O;②I2+2S2O32-=2I-+S4O62-
(2)淀粉遇碘变蓝色,达到滴定终点蓝色褪色,如半分钟不恢复说明达到滴定终点;
故答案为:淀粉溶液;溶液由蓝色变为无色,且半分钟不恢复;
(3)由①②方程式可知:IO3---3I2--6 S2O32-
n(IO3-)=
| 1 |
| 6 |
| 1 |
| 6 |
则250g 样品中含有碘元素的质量为:4×10-5mol×127g/mol×1000mg/g=5.08mg该加碘食盐中碘元素的含量为:5.08mg/0.250kg=20.32mg/kg
因为20.32mg/kg<20mg/kg,所以该碘盐合格.
故答案为:合格.
点评:本题考查氧化还原反应的配平,中和滴定问题,涉及物质的含量的测定,题目具有一定的难度,做题时注意根据利用得失电子守恒配方程式、原子守恒利用化学方程式计算

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
有如下三个热化学方程式:
H2(g)+
O2(g)═H2O(g)△H=a kJ?mol-1
H2(g)+
O2(g)═H2O(l)△H=b kJ?mol-1
2H2(g)+O2(g)═2H2O(l)△H=c kJ?mol-1
关于它们的下列表述正确的是( )
H2(g)+
| 1 |
| 2 |
H2(g)+
| 1 |
| 2 |
2H2(g)+O2(g)═2H2O(l)△H=c kJ?mol-1
关于它们的下列表述正确的是( )
| A、它们都是吸热反应 |
| B、a、b和c均为正值 |
| C、a<b |
| D、2b=c |
将下列各组物质按酸、碱、盐分类顺序排列,其中正确的是( )
| A、硫酸 纯碱 孔雀石[Cu2(OH)2CO3] |
| B、硝酸 烧碱 绿矾[FeSO4?7H2O] |
| C、醋酸 乙醇 碳酸钙 |
| D、盐酸 熟石灰 苛性钠 |
下列溶液能跟铜片反应,而且铜片的质量会减轻的是( )
| A、盐酸 |
| B、FeCl3溶液 |
| C、AgNO3溶液 |
| D、NaCl溶液 |
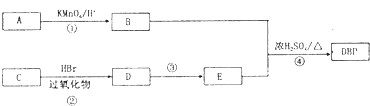 增塑剂是一种增加材料的柔软性或使材料液化的添加剂,不能用于食品、洒类等行业.DBP是增塑剂的一种,分子式为C16H22O4,可由常见的工业原料A(分子式为C8H10)和C合成DBP的路线如图所示:
增塑剂是一种增加材料的柔软性或使材料液化的添加剂,不能用于食品、洒类等行业.DBP是增塑剂的一种,分子式为C16H22O4,可由常见的工业原料A(分子式为C8H10)和C合成DBP的路线如图所示: