题目内容
设NA为阿伏加德罗常数的值.下列叙述正确的是( )
| A、常温下,17.6g丙烷中所含的极性共价键为4NA |
| B、常温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA |
| C、常温下,将5.6g铁投入到足量浓硝酸中,反应转移的电子数目为0.3NA |
| D、12 g金刚石中含有的共价键数为4 NA |
考点:阿伏加德罗常数
专题:
分析:A、根据n=
求出丙烷的物质的量,并根据丙烷的结构来分析;
B、乙烯和丁烯的最简式为CH2,根据n=
来计算;
C、常温下,铁遇浓硝酸钝化;
D、1mol金刚石中含有2molC-C.
| m |
| M |
B、乙烯和丁烯的最简式为CH2,根据n=
| m |
| M |
C、常温下,铁遇浓硝酸钝化;
D、1mol金刚石中含有2molC-C.
解答:
解:A、丙烷的物质的量n=
=
=0.4mol,而1mol丙烷中含8mol极性共价键,故0.4mol丙烷中含3.2mol极性共价键,故A错误;
B、乙烯和丁烯的最简式为CH2,21.0g乙烯和丁烯的混合物中CH2的物质的量n=
=
=1.5mol,故含有的碳原子为1.5mol,故B正确;
C、常温下,铁遇浓硝酸钝化,故C错误;
D、12g金刚石是1mol碳,金刚石的结构是按四面体成键的,一个碳上连着四个共价键,但是一个共价键是两个碳共用的,所以说共价键数为2NA,故D错误;
故选B.
| m |
| M |
| 17.6g |
| 44g/mol |
B、乙烯和丁烯的最简式为CH2,21.0g乙烯和丁烯的混合物中CH2的物质的量n=
| m |
| M |
| 21.0g |
| 14g/mol |
C、常温下,铁遇浓硝酸钝化,故C错误;
D、12g金刚石是1mol碳,金刚石的结构是按四面体成键的,一个碳上连着四个共价键,但是一个共价键是两个碳共用的,所以说共价键数为2NA,故D错误;
故选B.
点评:本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
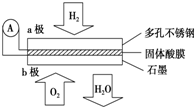 某固体酸燃料电池以CaHSO4固体为电解质传递H+,其基本结构见图,电池总反应可表示为:2H2+O2═2H2O,下列有关说法正确的是( )
某固体酸燃料电池以CaHSO4固体为电解质传递H+,其基本结构见图,电池总反应可表示为:2H2+O2═2H2O,下列有关说法正确的是( )| A、电子通过外电路从b极流向a极 |
| B、b极上的电极反应式为:O2+2H2O+4e-═4OH- |
| C、每转移0.1 mol电子,消耗标准下1.12 L的H2 |
| D、H+由b极通过固体酸电解质传递到a极 |
下列分子和离子中,中心原子原子轨道为sp3杂化,VSEPR模型为四面体形而分子或离子的空间构型为V形的是( )
| A、NH4+ |
| B、SO2 |
| C、H3O+ |
| D、OF2 |
设NA为阿伏伽德罗常数的数值,则下列说法中不正确的是( )
①2.24L氖气含有NA个电子,
②18gD2O中所含的中子数为10NA,
③标准状况下,11.2LSO3 含有的分子数为0.5NA,
④过氧化钠与水反应,若电子转移2NA,则产生的氧气为32g,
⑤在1L 0.1mol/L的碳酸钠溶液中,CO32-总数小于0.1NA.
①2.24L氖气含有NA个电子,
②18gD2O中所含的中子数为10NA,
③标准状况下,11.2LSO3 含有的分子数为0.5NA,
④过氧化钠与水反应,若电子转移2NA,则产生的氧气为32g,
⑤在1L 0.1mol/L的碳酸钠溶液中,CO32-总数小于0.1NA.
| A、①②③⑤ | B、①④⑤ |
| C、①②③ | D、②③⑤ |
下列离子方程式中,正确的是( )
| A、氧化亚铁与稀盐酸反应:FeO+2H+=Fe3++H2O |
| B、向氯化铜溶液中加入氢氧化钠溶液:Cu2++OH-=Cu(OH)2↓ |
| C、氯化铁溶液与铜反应:Fe3++Cu=Fe2++Cu2+ |
| D、向氯化亚铁溶液中通入氯气:2Fe2++Cl2=2Fe3++2Cl-. |
酒精灯的火焰分为三层,由外到内依次为外焰、内焰、焰心,若把一根洁净的铜丝,由外焰逐渐深入到内焰,能观察到的现象是( )
| A、始终是红色 |
| B、在外焰变为黑色,到内焰变为红色 |
| C、由红色变为黑色 |
| D、在外焰是红色,到内焰变为黑色 |
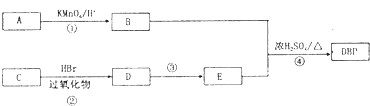 增塑剂是一种增加材料的柔软性或使材料液化的添加剂,不能用于食品、洒类等行业.DBP是增塑剂的一种,分子式为C16H22O4,可由常见的工业原料A(分子式为C8H10)和C合成DBP的路线如图所示:
增塑剂是一种增加材料的柔软性或使材料液化的添加剂,不能用于食品、洒类等行业.DBP是增塑剂的一种,分子式为C16H22O4,可由常见的工业原料A(分子式为C8H10)和C合成DBP的路线如图所示:
 RCHO
RCHO