题目内容
20.化学在能源开发与利用中起着重要的作用,如甲醇、乙醇、二甲醚(CH3OCH3)等都是新型燃料.(1)乙醇是重要的化工产品和液体燃料,可以利用下列反应制取乙醇.
2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)△H=a kJ/mol
在一定压强下,测得上述反应的实验数据如表.
| 温度/K CO2转化率% $\frac{n({H}_{2})}{n(C{O}_{2})}$ | 500 | 600 | 700 | 800 |
| 1.5 | 45% | 33% | 20% | 12% |
| 2.0 | 60% | 43% | 28% | 15% |
| 3.0 | 83% | 62% | 37% | 22% |
①上述反应的a小于0(填“大于”或“小于”).
②在一定温度下,提高氢碳(即$\frac{n({H}_{2})}{n(C{O}_{2})}$)比,平衡常数K值不变(填“增大”、“减小”、或“不变”).
(2)催化剂存在的条件下,在固定容积的密闭容器中投入一定量的CO和H2,同样可制得乙醇(可逆反应).该反应过程中能量变化如图所示:
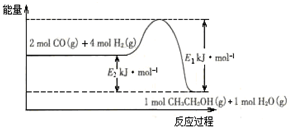
在一定温度下,向上述密闭容器中加入1mol CO、3mol H2及固体催化剂,使之反应.平衡时,反应产生的热量为Q kJ,若温度不变的条件下,向上述密闭容器中加入4mol CO、12mol H2及固体催化剂,平衡时,反应产生的热量为w kJ,则w的范围为4Q<w<2 (E2-E1).
(3)以乙醇蒸气、空气、氢氧化钠溶液为原料,石墨为电极可构成燃料电池,其工作原理与甲烷燃料电池原理相类似.该电池中负极上的电极反应式是CH3CH2OH-12e-+16OH-=2CO32-+11H2O.使用上述乙醇燃料电池电解(Pt电极)一定浓度的硫酸铜溶液通电一段时间后,向所得的溶液中加入0.1mol Cu(OH)2后恰好恢复到电解前的浓度和pH,则乙醇燃料电池在电解过程中转移电子数是0.4NA.
分析 (1)①升高温度化学平衡向吸热方向移动;
②化学平衡常数只与温度有关;
(2)该反应热化学方程式为2CO(g)+4H2(g)=CH3CH2OH(g)+H2O(g)△H=-(E2-E1)kJ/mol
在一定温度下,向上述密闭容器中加入1mol CO、3mol H2,平衡时,反应产生的热量为Q kJ小于$\frac{1}{2}$ (E2-E1)kJ,
该反应前后气体体积减小,增大压强平衡正向移动,若温度不变的条件下,向上述密闭容器中加入4mol CO、12mol H2平衡时,反应产生的热量为w kJ,如果4molCO完全反应放出的热量为2 (E2-E1)kJ,如果两种情况下CO转化率相同,则放出的热量为4Q,实际上4molCO反应时转化率大于1molCO,所以放出的热量大于4Q;
(3)该原电池负极上乙醇失电子和氢氧根离子反应生成碳酸根离子和水;0.1mol Cu(OH)2相当于0.1molCuO.H2O,即0.1molCuO、0.1molH2O,阴极上析出Cu和氢气,阳极上只析出氧气,根据氧原子与转移电子之间的关系式计算转移电子数.
解答 解:(1)①升高温度化学平衡向吸热方向移动,升高温度,二氧化碳转化率降低,说明平衡逆向移动,则逆反应是吸热反应,所以正反应是放热反应,即a<0,
故答案为:小于;
②化学平衡常数只与温度有关,温度不变化学平衡常数不变,所以该反应化学平衡常数不变,故答案为:不变;
(2)该反应热化学方程式为2CO(g)+4H2(g)=CH3CH2OH(g)+H2O(g)△H=-(E2-E1)kJ/mol
在一定温度下,向上述密闭容器中加入1mol CO、3mol H2,平衡时,反应产生的热量为Q kJ小于$\frac{1}{2}$ (E2-E1)kJ,
该反应前后气体体积减小,增大压强平衡正向移动,若温度不变的条件下,向上述密闭容器中加入4mol CO、12mol H2平衡时,反应产生的热量为w kJ,如果4molCO完全反应放出的热量为2 (E2-E1)kJ,如果两种情况下CO转化率相同,则放出的热量为4Q,实际上4molCO反应时转化率大于1molCO,所以放出的热量大于4Q,所以放出的热量4Q<w<2 (E2-E1),故答案为:4Q<w<2 (E2-E1);
(3)该原电池负极上乙醇失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为CH3CH2OH-12e-+16OH-=2CO32-+11H2O;0.1mol Cu(OH)2相当于0.1molCuO.H2O,即0.1molCuO、0.1molH2O,阴极上析出Cu和氢气,阳极上只析出氧气,根据原子守恒得n(O2)=2n[Cu(OH)2]=0.1mol=0.1mol,生成1个氧分子转移4个电子,所以生成0.1molO2原子转移0.4mol电子,电子数为 0.4 NA,
故答案为:CH3CH2OH-12e-+16OH-=2CO32-+11H2O; 0.4 NA.
点评 本题考查较综合,涉及化学平衡计算、反应热计算、原电池原理等知识点,侧重考查学生分析计算能力,明确化学平衡常数影响因素、原电池电极反应式的书写等知识点是解本题关键,注意:所有的平衡常数只与温度有关,与物质的物质的量多少及浓度无关,难点是电极反应式的书写,要结合电解质溶液酸碱性书写.

 口算能手系列答案
口算能手系列答案| A. | 1:2:3 | B. | 3:2:1 | C. | 9:3:1 | D. | 6:3:2 |

| A. | 闭合开关K后,电流计 指针不发生偏转,证明酒精溶液是非电解质 指针不发生偏转,证明酒精溶液是非电解质 | |
| B. | 闭合开关,往溶液中通入氯气,随着气体通入,电流计示数增大,故氯气是电解质 | |
| C. | 取用0.1 mol•L-1的蔗糖溶液替换酒精溶液,电流计的示数相同,说明蔗糖是非电解质 | |
| D. | 闭合开关,往烧杯中加NaCl固体,虽然固体溶解,由于不反应,故电流计指针不发生偏转 |
| A. | 酸性强弱HX>HY>HZ | B. | 有两种盐能发生水解 | ||
| C. | 分别稀释上述三种溶液,pH均变小 | D. | 三种溶液中离子总数不相同 |
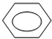 +HO-NO2→
+HO-NO2→ +H2O.
+H2O.