题目内容
16.下列事实可以证明MOH是弱碱的有( )①0.1mol/L MOH溶液能使酚酞溶液变红
②常温下,0.1mol/L MOH溶液的pH=12
③0.1mol/L MOH溶液的导电性比0.1mol/L NaOH溶液弱
④等体积的0.1mol/L MOH溶液与0.1mol/L HCl溶液恰好完全反应.
| A. | .①②③ | B. | .②③ | C. | ②④ | D. | ③④ |
分析 MOH是弱碱,说明MOH部分电离,溶液中存在电离平衡,根据MOH的电离程度划分强弱电解质,据此分析解答.
解答 解:①0.1mol/L MOH可以使酚酞试液变红说明 MOH能电离出氢氧根离子,而不能说明 MOH的电离程度,所以不能证明 MOH是弱电解质,故①错误;
②常温下,0.1mol/L MOH溶液的pH=12,即氢氧根离子的浓度为0.01mol/L,MOH没有完全电离,则MOH为弱电解质,故②正确;
③溶液的导电性与离子浓度成正比,0.1mol/L MOH溶液的导电性比0.1mol/L NaOH溶液弱,说明 MOH溶液中离子浓度较小,说明 MOH部分电离,故③正确;
④等体积的0.1mol/L MOH溶液与0.1mol/L HCl溶液恰好完全反应,无论是强碱还是弱碱,都恰好完全反应,故④错误;
故选B.
点评 本题考查了电解质强弱的判断,根据电离程度划分强弱电解质,题目难度不大,注意把握弱电解质的电离特点以及弱电解质的判断方法,侧重于考查学生的分析能力和对基础知识的应用能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
7.下列叙述中,正确的是( )
| A. | 聚乙烯、植物油都是混合物,都能使溴的四氯化碳溶液褪色 | |
| B. | 向氯乙烷中加入硝酸银溶液,可以快速鉴定其中的氯原子 | |
| C. | 将等体积的苯、汽油和水在试管中充分振荡后静置,现象如图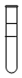 | |
| D. | 直馏汽油和裂化汽油中分别滴加溴水可以观察到不同现象 |
11.用铂电极分别电解下列物质的溶液,阴极和阳极上同时都有气体产生且溶液的pH下降的是( )
| A. | KCl | B. | CuSO4 | C. | HCl | D. | H2SO4 |
8.如图是某反应在密闭容器中反应前后的分子状况示意图,“ ”和“
”和“ ”分别表示不同的原子.下列对此反应的分类一定不正确的是( )
”分别表示不同的原子.下列对此反应的分类一定不正确的是( )

 ”和“
”和“ ”分别表示不同的原子.下列对此反应的分类一定不正确的是( )
”分别表示不同的原子.下列对此反应的分类一定不正确的是( )
| A. | 化合反应 | B. | 可逆反应 | C. | 置换反应 | D. | 氧化还原反应 |
5.下列实验操作正确的是( )
| A. | 过滤操作中,漏斗下端要紧靠烧杯内壁,而分液操作中,无此要求 | |
| B. | 蒸馏操作时,应使温度计水银球插入蒸馏烧瓶的溶液中 | |
| C. | 蒸发操作时,应用玻璃棒不断搅拌待有大量晶体出现,停止搅拌,继续把水份蒸干 | |
| D. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
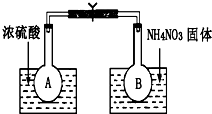 已知:2NO2(g)?N2O4(g)△H=-52.7kJ/mol,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验:
已知:2NO2(g)?N2O4(g)△H=-52.7kJ/mol,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验: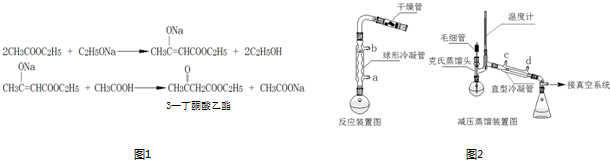
 CH3COOCH2CH3+H2O,反应类型是酯化反应.
CH3COOCH2CH3+H2O,反应类型是酯化反应.