题目内容
Na2O2是常见的氧化剂,某化学小组的同学欲通过以下实验确定炭粉与Na2O2反应的产物.
【实验步骤】
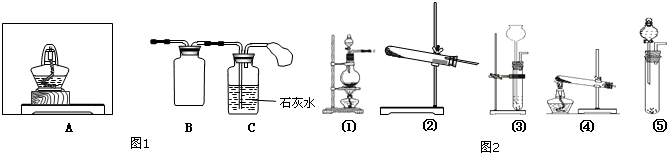
Ⅰ.按如图1所示装置(部分仪器未画出)组装仪器,并检查装置气密性.
Ⅱ.将0.6g炭粉与3.9g Na2O2均匀混合,装入A装置中的反应容器,在靠近反应容器口处放置一张湿润的氯化钯试纸(湿润氯化钯试纸遇CO变黑,可用于检验是否有CO生成).
Ⅲ.用酒精灯微微加热A装置中的反应容器.
【实验现象】
A装置中发生剧烈反应并产生火花,氯化钯试纸未变黑,石灰水未变浑浊.
请回答:
(1)在A装置中方框内的仪器可以选用 ,(从图2中①②③④⑤中选出所需要的装置,使仪器装置图完整)
(2)装置B的作用是
(3)通过探究发现,装置A中发生的反应为2Na2O2+C
Na2CO3+X,X物质的化学式是 .
(4)CO在潮湿环境中可将氯化钯还原为黑色粉末状的钯(Pd),同时生成另外两种新物质.已知反应过程中转移6.02×1023个电子时,生成53g Pd,该反应的化学方程式为 .
(5)将装置A中充分反应后所得产物溶于适量水中.
①所得溶液的溶质是 (填化学式).
②常温,若使所得溶液与100mL稀盐酸恰好完全反应至溶液pH=7,该盐酸的物质的量浓度为 .
(6)写出Na2O2的一种重要用途 .
【实验步骤】
Ⅰ.按如图1所示装置(部分仪器未画出)组装仪器,并检查装置气密性.

Ⅱ.将0.6g炭粉与3.9g Na2O2均匀混合,装入A装置中的反应容器,在靠近反应容器口处放置一张湿润的氯化钯试纸(湿润氯化钯试纸遇CO变黑,可用于检验是否有CO生成).
Ⅲ.用酒精灯微微加热A装置中的反应容器.
【实验现象】
A装置中发生剧烈反应并产生火花,氯化钯试纸未变黑,石灰水未变浑浊.
请回答:
(1)在A装置中方框内的仪器可以选用
(2)装置B的作用是
(3)通过探究发现,装置A中发生的反应为2Na2O2+C
| ||
(4)CO在潮湿环境中可将氯化钯还原为黑色粉末状的钯(Pd),同时生成另外两种新物质.已知反应过程中转移6.02×1023个电子时,生成53g Pd,该反应的化学方程式为
(5)将装置A中充分反应后所得产物溶于适量水中.
①所得溶液的溶质是
②常温,若使所得溶液与100mL稀盐酸恰好完全反应至溶液pH=7,该盐酸的物质的量浓度为
(6)写出Na2O2的一种重要用途
考点:性质实验方案的设计,钠的重要化合物
专题:
分析:(1)根据A的作用是:炭粉与Na2O2均匀混合,装入A装置中作为反应容器,据此选择仪器;
(2)B为安全瓶,据此确定作用;
(3)依据原子个数守恒判断X;
(4)n(Pd)=
=0.5mol,转移电子的物质的量为1mol,反应为为PdCl2、CO和H2O,生成物应为CO2和HCl;
(5)①将装置A中充分反应后所得产物溶于适量水中,得到碳酸钠和氢氧化钠;
②NaOH、Na2CO3与HCl反应的产物是氯化钠溶液,根据n(Cl-)=n(Na+)来计算回答.
(6)过氧化钠可以和水以及二氧化碳反应生成氧气,据此回答其应用.
(2)B为安全瓶,据此确定作用;
(3)依据原子个数守恒判断X;
(4)n(Pd)=
| 53g |
| 106g/mol |
(5)①将装置A中充分反应后所得产物溶于适量水中,得到碳酸钠和氢氧化钠;
②NaOH、Na2CO3与HCl反应的产物是氯化钠溶液,根据n(Cl-)=n(Na+)来计算回答.
(6)过氧化钠可以和水以及二氧化碳反应生成氧气,据此回答其应用.
解答:
解:(1)炭粉与Na2O2均匀混合,装入A装置中作为反应容器,装置A应该是能盛放固体来加热的反应容器,②符合,故答案为:②;
(2)B为安全瓶,可防止倒吸,故答案为:防止倒吸;
(3)2Na2O2+C
Na2CO3+X,由原子个数守恒,可知X中含有2个钠原子1个氧原子,所以X为Na2O,故答案为:Na2O;
(4)n(Pd)=
=0.5mol,转移电子的物质的量为1mol,反应为为PdCl2、CO和H2O,生成物应为CO2和HCl,则反应的方程式为PdCl2+CO+H2O=Pd+CO2+2HCl,
故答案为:PdCl2+CO+H2O=Pd+CO2+2HCl.
(5)①将装置A中充分反应后所得产物:Na2CO3、Na2O溶于适量水中,得到碳酸钠和氢氧化钠,故答案为:NaOH、Na2CO3;
②3.9g Na2O2 0.1mol,的物质的量是0.05mol,钠离子若使所得溶液NaOH、Na2CO3与100mL稀盐酸恰好完全反应,至溶液pH=7,产物是氯化钠溶液,n(Cl-)=n(Na+)=n(HCl)=0.1mol,该盐酸的物质的量浓度为
=1mol/L,故答案为:1 mol/L;
(6)过氧化钠可以和水以及二氧化碳反应生成氧气,所以过氧化钠可以做呼吸面具中O2的来源,故答案为:用于呼吸面具中作为O2的来源.
(2)B为安全瓶,可防止倒吸,故答案为:防止倒吸;
(3)2Na2O2+C
| ||
(4)n(Pd)=
| 53g |
| 106g/mol |
故答案为:PdCl2+CO+H2O=Pd+CO2+2HCl.
(5)①将装置A中充分反应后所得产物:Na2CO3、Na2O溶于适量水中,得到碳酸钠和氢氧化钠,故答案为:NaOH、Na2CO3;
②3.9g Na2O2 0.1mol,的物质的量是0.05mol,钠离子若使所得溶液NaOH、Na2CO3与100mL稀盐酸恰好完全反应,至溶液pH=7,产物是氯化钠溶液,n(Cl-)=n(Na+)=n(HCl)=0.1mol,该盐酸的物质的量浓度为
| 0.1mol |
| 0.1L |
(6)过氧化钠可以和水以及二氧化碳反应生成氧气,所以过氧化钠可以做呼吸面具中O2的来源,故答案为:用于呼吸面具中作为O2的来源.
点评:本题为实验探究题,题目难度中等,把握实验基本操作方法和物质的性质是解题关键,注意根据反应的现象判断反应原理.

练习册系列答案
相关题目
M(NO3)2热分解化学方程式为:2M(NO3)2
2MO+4NO2↑+O2↑,加热37.6g M(NO3)2使其完全分解,在标准状况下收集11200mL的气体,那么M的摩尔质量是( )
| ||
| A、24g/mol |
| B、64g/mol |
| C、65g/mol |
| D、40g/mol |
用NA表示阿伏德罗常数,下列叙述正确的是( )
| A、标准状况下,22.4LH2O含有的分子数为 NA |
| B、常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA |
| C、通常状况下,NA 个CO2分子占有的体积为22.4L |
| D、物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl- 个数为 NA |
下列反应的离子方程式错误的是( )
| A、向碳酸氢钙溶液中加入过量氢氧化钠 Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32- |
| B、氢氧化钡溶液与硫酸氢钠溶液1:1混合Ba2++OH-+H++SO42-=BaSO4↓+H2O |
| C、氢氧化钙溶液和碳酸氢镁反应:Ca2++OH-+HCO3-═CaCO3↓+H2O |
| D、向溴化亚铁溶液中通入过量氯气:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- |
有关合成氨工业的下列说法中,正确的是( )
| A、从合成塔出来的混合气体,NH3的含量较小,所以生产氨的工厂的效率都很低 |
| B、由于氨可液化分离出来,N2、H2在实际生产中循环使用,所以总体来说氨的产率很高 |
| C、合成氨工业的反应温度控制在500℃,目的是使化学平衡向正反应方向移动 |
| D、合成氨厂采用的压强是20 MPa~50 MPa,因在该压强下铁触媒的活性最大 |
化学无处不在,与化学有关的说法正确的是( )
| A、中性溶液的pH都相等 |
| B、新型净水材料高铁酸钠是生产自来水理想的净水剂和杀菌剂 |
| C、127I和131I2互为同位素 |
| D、△H<0,△S<0的化学反应不能自发进行 |
一包由常见盐混合组成的白色粉末,其中只可能含Na+、K+、Al3+、CO32-、HCO3-、SO42-、SO32-、NO2-中的若干种离子.某同学对该粉末进行如下实验:

说法正确的是( )

说法正确的是( )
| A、白色沉淀甲是Al(OH)3,气体甲是CO2,所以混合物一定含Al3+和HCO3- |
| B、原混合物一定含有Na+、Al3+、NO2- |
| C、白色沉淀乙是BaSO4,所以原混合物一定含有SO42- |
| D、气体乙一定是NO和NO2的混合气体 |
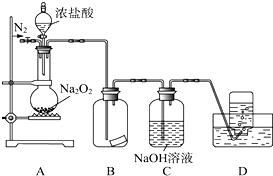 某研究性学习小组,为了探究过氧化钠的强氧化性,设计了如图的实验装置.实验步骤及现象如下:
某研究性学习小组,为了探究过氧化钠的强氧化性,设计了如图的实验装置.实验步骤及现象如下: Na2O2+
Na2O2+