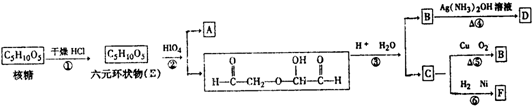
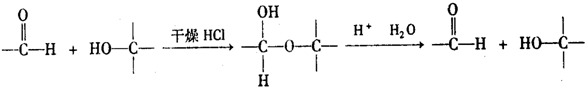
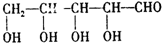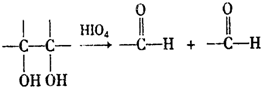题目内容
某电镀铜厂有两种废水,分别含有CN-和Cr2O72-等有毒离子,拟用NaClO和Na2S2O3按照下列流程进行处理.
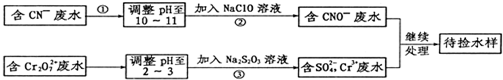
请完成下列填空:
(1)HCN有剧毒,电子式是 ,其分子属于 (填“极性”、“非极性”)分子.
(2)表示原子结构的化学用语有:原子结构示意图、核外电子排布式、轨道表示式.从中选择最详尽描述核外电子运动状态的方式,来表示氧原子的最外层电子的运动状态: ,其中最外层有 种不同能量的电子.
(3)下列事实能说明氯与硫两元素非金属性相对强弱的是 .
a.相同条件下水溶液的pH:NaClO>Na2S2O3 b.还原性:H2S>HCl
c.相同条件下水溶液的酸性:HClO3>H2SO3 d.稳定性:HCl>H2S
(4)写出流程③的离子方程式为: .
(5)反应③中,每消耗0.5mol Cr2O72-转移的电子数为 ;
(6)取少量待测水样于试管中,加入NaOH溶液观察到有蓝色沉淀生成,继续加至不再产生蓝色沉淀为止,再向溶液中加入足量Na2S溶液,蓝色沉淀转化成黑色沉淀,解释产生该现象的原因 .

请完成下列填空:
(1)HCN有剧毒,电子式是
(2)表示原子结构的化学用语有:原子结构示意图、核外电子排布式、轨道表示式.从中选择最详尽描述核外电子运动状态的方式,来表示氧原子的最外层电子的运动状态:
(3)下列事实能说明氯与硫两元素非金属性相对强弱的是
a.相同条件下水溶液的pH:NaClO>Na2S2O3 b.还原性:H2S>HCl
c.相同条件下水溶液的酸性:HClO3>H2SO3 d.稳定性:HCl>H2S
(4)写出流程③的离子方程式为:
(5)反应③中,每消耗0.5mol Cr2O72-转移的电子数为
(6)取少量待测水样于试管中,加入NaOH溶液观察到有蓝色沉淀生成,继续加至不再产生蓝色沉淀为止,再向溶液中加入足量Na2S溶液,蓝色沉淀转化成黑色沉淀,解释产生该现象的原因
考点:物质分离和提纯的方法和基本操作综合应用,元素周期律的作用,氧化还原反应的计算
专题:实验设计题
分析:(1)HCN是共价化合物,根据电子式的书写方法来回答,不同元素之间形成的化学键极性共价键,该键形成的不对称分子是极性分子;
(2)轨道表示式可以详尽描述氧原子的核外电子运动状态的方式;
(3)比较非金属元素的非金属性强弱,可根据单质之间的置换反应、对应最高价氧化物的水化物的酸性、氢化物的稳定性等角度判断;
(4)在酸性环境下,重铬酸根离子可将硫代硫酸根离子氧化,据此书写离子方程式;
(5)利用反应:3S2O32-+4Cr2O72-+26H+=6SO42-+8Cr3++13H2O来计算每0.5molCr2O72-转移的电子数;
(6)根据铜离子与氢氧根离子反应生成沉淀及沉淀的转化来分析.
(2)轨道表示式可以详尽描述氧原子的核外电子运动状态的方式;
(3)比较非金属元素的非金属性强弱,可根据单质之间的置换反应、对应最高价氧化物的水化物的酸性、氢化物的稳定性等角度判断;
(4)在酸性环境下,重铬酸根离子可将硫代硫酸根离子氧化,据此书写离子方程式;
(5)利用反应:3S2O32-+4Cr2O72-+26H+=6SO42-+8Cr3++13H2O来计算每0.5molCr2O72-转移的电子数;
(6)根据铜离子与氢氧根离子反应生成沉淀及沉淀的转化来分析.
解答:
解:(1)HCN是共价化合物,电子式为: ,不同元素之间形成的化学键极性共价键,该键形成的不对称分子是极性分子,
,不同元素之间形成的化学键极性共价键,该键形成的不对称分子是极性分子,
故答案为: ;极性;
;极性;
(2)轨道表示式可以详尽描述氧原子的核外电子运动状态的方式,即 ,从该轨道表示式可以看出:最外层有2种不同能量的电子,
,从该轨道表示式可以看出:最外层有2种不同能量的电子,
故答案为:2;
(3)a.相同条件下水溶液的pH:NaClO>Na2S2O3,则酸性是:HClO<H2S2O3,但是元素对应最高价氧化物的水化物的酸性强弱才能说明氯元素的非金属性比硫元素强,故a错误;
b.还原性:H2S>HCl,即氯气与H2S能发生置换反应,说明氯气的氧化性大于S,元素的非金属性Cl大于S,故b正确;
c.相同条件下水溶液的酸性:HClO3>H2SO3,但是元素对应最高价氧化物的水化物的酸性强弱才能说明氯元素的非金属性比硫元素强,故c错误;
d.元素的非金属性越强,对应氢化物的稳定性越强,氯化氢比硫化氢稳定,稳定性:HCl>H2S,故d正确;
故选bd;
(4)在酸性环境下,重铬酸根离子氧化性可将硫代硫酸根离子氧化为硫酸根离子,自身被还原为Cr3+,即3S2O32-+4Cr2O72-+26H+=6SO42-+8Cr3++13H2O,
故答案为:3S2O32-+4Cr2O72-+26H+=6SO42-+8Cr3++13H2O;
(5)根据反应:3S2O32-+4Cr2O72-+26H+=6SO42-+8Cr3++13H2O,每4molCr2O72-被还原转移的电子是24mol,所以每0.5molCr2O72-转移的电子数3.0NA(或1.806×1024),故答案为:3.0NA(或1.806×1024);
(6)因铜离子与氢氧根离子反应生成氢氧化铜沉淀,CuS比Cu(OH)2更难溶,则加入Na2S溶液能发生沉淀的转化,
故答案为:待检水样中还有Cu2+,加碱发生Cu2++2OH-═Cu(OH)2↓,再加入Na2S溶液,CuS比Cu(OH)2更难溶,则发生Cu(OH)2(s)+S2-(aq)═CuS(s)+2OH-(aq),使沉淀向更难溶方向转化.
 ,不同元素之间形成的化学键极性共价键,该键形成的不对称分子是极性分子,
,不同元素之间形成的化学键极性共价键,该键形成的不对称分子是极性分子,故答案为:
 ;极性;
;极性; (2)轨道表示式可以详尽描述氧原子的核外电子运动状态的方式,即
 ,从该轨道表示式可以看出:最外层有2种不同能量的电子,
,从该轨道表示式可以看出:最外层有2种不同能量的电子,故答案为:2;
(3)a.相同条件下水溶液的pH:NaClO>Na2S2O3,则酸性是:HClO<H2S2O3,但是元素对应最高价氧化物的水化物的酸性强弱才能说明氯元素的非金属性比硫元素强,故a错误;
b.还原性:H2S>HCl,即氯气与H2S能发生置换反应,说明氯气的氧化性大于S,元素的非金属性Cl大于S,故b正确;
c.相同条件下水溶液的酸性:HClO3>H2SO3,但是元素对应最高价氧化物的水化物的酸性强弱才能说明氯元素的非金属性比硫元素强,故c错误;
d.元素的非金属性越强,对应氢化物的稳定性越强,氯化氢比硫化氢稳定,稳定性:HCl>H2S,故d正确;
故选bd;
(4)在酸性环境下,重铬酸根离子氧化性可将硫代硫酸根离子氧化为硫酸根离子,自身被还原为Cr3+,即3S2O32-+4Cr2O72-+26H+=6SO42-+8Cr3++13H2O,
故答案为:3S2O32-+4Cr2O72-+26H+=6SO42-+8Cr3++13H2O;
(5)根据反应:3S2O32-+4Cr2O72-+26H+=6SO42-+8Cr3++13H2O,每4molCr2O72-被还原转移的电子是24mol,所以每0.5molCr2O72-转移的电子数3.0NA(或1.806×1024),故答案为:3.0NA(或1.806×1024);
(6)因铜离子与氢氧根离子反应生成氢氧化铜沉淀,CuS比Cu(OH)2更难溶,则加入Na2S溶液能发生沉淀的转化,
故答案为:待检水样中还有Cu2+,加碱发生Cu2++2OH-═Cu(OH)2↓,再加入Na2S溶液,CuS比Cu(OH)2更难溶,则发生Cu(OH)2(s)+S2-(aq)═CuS(s)+2OH-(aq),使沉淀向更难溶方向转化.
点评:本题考查了物质的分离和提纯方法、氧化还原反应,注重了化学与实际生产的联系,学生应学会利用物质的性质、元素的化合价、电子守恒等来解答.

练习册系列答案
相关题目
下列关于钠的说法不正确的是( )
| A、金属钠和氧气反应,条件不同,产物不同 |
| B、钠长期置于空气中,表面不能形成致密氧化膜 |
| C、钠与水反应时,钠熔成小球在水面四处游动 |
| D、由于钠比较活泼,所以它能从溶液中置换出金属活动性顺序表中钠后面的金属 |
检验试样中有无某离子的操作及结论不合理的是( )
| A、先加HCl无明显现象,再加BaCl2有白色沉淀,一定有SO42- |
| B、加入稀盐酸产生能使澄清石灰水变浑浊的无色无味气体,则溶液中一定有CO32- |
| C、加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ |
| D、透过蓝色钴玻璃观察到焰色为紫色,则待测液中一定含有钾元素 |

 某河道两旁有甲、乙两个化工厂.它们排放的澄清工业废水中,共含有Na+、Ag+、Fe3+、C1-、OH-、NO3-六种离子.
某河道两旁有甲、乙两个化工厂.它们排放的澄清工业废水中,共含有Na+、Ag+、Fe3+、C1-、OH-、NO3-六种离子.