题目内容
有关合成氨工业的下列说法中,正确的是( )
| A、从合成塔出来的混合气体,NH3的含量较小,所以生产氨的工厂的效率都很低 |
| B、由于氨可液化分离出来,N2、H2在实际生产中循环使用,所以总体来说氨的产率很高 |
| C、合成氨工业的反应温度控制在500℃,目的是使化学平衡向正反应方向移动 |
| D、合成氨厂采用的压强是20 MPa~50 MPa,因在该压强下铁触媒的活性最大 |
考点:工业合成氨
专题:
分析:A、虽然反应出来的混合气体中NH3比较低,但原料循环使用,连续化生产,所以生产氨的工厂效率不低.
B、由于氨易液化,可以抽出氨气,使平衡正移,提高原料转化率,而且N2、H2是循环使用;
C、合成氨是放热反应,所以低温有利,但反应速率跟温度有关,温度越高速率越大;
D、反应是分子数减小的反应,高压有利于向正反应移动.
B、由于氨易液化,可以抽出氨气,使平衡正移,提高原料转化率,而且N2、H2是循环使用;
C、合成氨是放热反应,所以低温有利,但反应速率跟温度有关,温度越高速率越大;
D、反应是分子数减小的反应,高压有利于向正反应移动.
解答:
解:A、虽然反应出来的混合气体NH3比较低,但原料循环使用,连续化生产,所以生产氨的工厂效率不低,故A错误;
B、由于氨易液化,可以抽出氨气,使平衡正移,提高原料转化率,而且N2、H2是循环使用,所以总体来说氨的生产率很高,故B正确;
C、合成氨是放热反应,所以低温有利,但反应速率跟温度有关,温度越高速率越大,所以温度是取在既保证一定速率,又保证反应尽量向正反应移动,同时还要确保催化剂活性,因为催化剂活性跟温度关系极大,一般合成氨反应500℃是保证催化活性最大,不是为了使化学平衡向正反应方向移动,故C错误;
D、合成氨的反应是分子数减小的反应,高压有利于向正反应方向移动,且能提高正反应速率,跟催化剂无关,故D错误;
故选B.
B、由于氨易液化,可以抽出氨气,使平衡正移,提高原料转化率,而且N2、H2是循环使用,所以总体来说氨的生产率很高,故B正确;
C、合成氨是放热反应,所以低温有利,但反应速率跟温度有关,温度越高速率越大,所以温度是取在既保证一定速率,又保证反应尽量向正反应移动,同时还要确保催化剂活性,因为催化剂活性跟温度关系极大,一般合成氨反应500℃是保证催化活性最大,不是为了使化学平衡向正反应方向移动,故C错误;
D、合成氨的反应是分子数减小的反应,高压有利于向正反应方向移动,且能提高正反应速率,跟催化剂无关,故D错误;
故选B.
点评:本题考查了合成氨的原理,同时考查了外界条件对化学平衡的影响,比较基础,注意理解温度、浓度、压强、催化剂等外界条件对化学平衡的影响.

练习册系列答案
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案
相关题目
下列有关0.1mol?L-1 NaOH 溶液的叙述正确的是( )
| A、0.1L该溶液中含有NaOH 4.0g |
| B、100 mL该溶液中含有OH-0.01mol |
| C、从1L该溶液中取出100mL,所取出的NaOH溶液的浓度为0.01 mol?L-1 |
| D、在1 L水中溶解4g NaOH即可配制得0.1 mol?L-1NaOH溶液 |
下列变化过程,属于放热过程的是( )
| A、酸碱中和反应 |
| B、液态水变成水蒸气 |
| C、弱酸弱碱电离 |
| D、用FeCl3饱和溶液制Fe(OH)3胶体 |
下列离子方程式书写正确的是( )
| A、少量的二氧化硫气体通入冷氨水中:SO2+NH3?H2O═HSO3-+NH4+ |
| B、H218O 中投入Na2O2固体:2H218O+2Na2O2═4Na++4OH-+18O2↑ |
| C、碳酸氢钙溶液中加过量澄清石灰水:Ca2++OH-+HCO3-═CaCO3↓+H2O |
| D、碳酸钠的水解反应:CO32-+H3O+?HCO3-+H2O |
最近媒体报道了一些化学物质,如:爆炸力极强的N5、结构类似白磷的N4、比黄金还贵的18O2、太空中的甲醇气团等,下列说法正确的是( )
| A、18O2和16O2是两种不同的核素 |
| B、将a克铜丝灼烧成黑色后趁热插入乙醇中,铜丝变红,质量小于a克 |
| C、N4分子为正方形结构,每个分子中含有6个共价键 |
| D、2N5=5N2是化学变化 |
检验试样中有无某离子的操作及结论不合理的是( )
| A、先加HCl无明显现象,再加BaCl2有白色沉淀,一定有SO42- |
| B、加入稀盐酸产生能使澄清石灰水变浑浊的无色无味气体,则溶液中一定有CO32- |
| C、加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ |
| D、透过蓝色钴玻璃观察到焰色为紫色,则待测液中一定含有钾元素 |
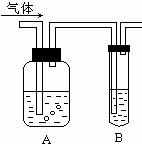 如图把气体缓慢通过盛有足量试剂的试剂瓶A,试管B不能观察到明显现象的是( )
如图把气体缓慢通过盛有足量试剂的试剂瓶A,试管B不能观察到明显现象的是( )