题目内容
8.已知氨水与醋酸的电离程度在同温同浓度下相等,溶有一定量氨的氯化铵溶液呈碱性.现向少量的Mg(OH)2悬浊液中加入适量的饱和氯化铵溶液,固体完全溶解.甲同学的解释是:
Mg(OH)2(s)?Mg2+(aq)+2OH?(ap)①
NH4++H2O?NH3•H2O+H+②
由于NH4+水解显酸性,H+与OH-反应生成水,导致①导致的平衡右移,沉淀溶解;
乙同学的解释是:
Mg(OH)2(s)?Mg2+(aq)+2OH?(ap)①
NH4++OH-?NH3•H2O②
由于NH4Cl电离出的NH4+与Mg(OH)2电离出的OH-结合,生成了弱电解质NH3•H2O,导致反应①的平衡右移,Mg(OH)2沉淀溶解.
(1)丙同学不能肯定哪位同学的解释合理,于是选用下列一种试剂来证明甲、乙两位同学的解释只有一种正确,他选用的试剂是B(填写编号).
A、NH4NO3B、CH3COONH4C、Na2CO3D、NH3•H2O
(2)请你说明丙同学作出该选择的理由是醋酸铵溶液显中性.
(3)丙同学将所选试剂滴入Mg(OH)2的悬浊液中,Mg(OH)2溶解;由此推知,甲和乙哪位同学的解释更合理?乙(填“甲”或“乙”);写出NH4Cl饱和溶液使Mg(OH)2悬浊液溶解的离子方程式2NH4++Mg(OH)2=2NH3•H2O+Mg2+.
分析 为了证明Mg(OH)2悬浊液与氯化铵溶液的反应原理,可加入醋酸铵溶液检验,因醋酸铵溶液呈中性,如甲同学的解释正确,则氢氧化镁不溶解,如氢氧化镁溶解,则乙同学的解释正确,据此进行解答.
解答 解:(1)硝酸铵和氯化铵相似,只有铵根离子的水解,而碳酸钠和氨水溶液都呈碱性,只有B符合,
故答案为:B;
(2)醋酸铵溶液呈中性,可证明是否由于铵根离子水解呈酸性的原因导致氢氧化镁溶解,
故答案为:醋酸铵溶液显中性;
(3)将所选试剂滴入Mg(OH)2的浊液中,Mg(OH)2溶解,可说明乙同学的解释正确,
则NH4Cl饱和溶液使Mg(OH)2悬浊溶解的离子方程式为2NH4++Mg(OH)2=2NH3•H2O+Mg2+,
故答案为:乙;2NH4++Mg(OH)2=2NH3•H2O+Mg2+.
点评 本题考查化学实验方案的设计和评价,题目难度中等,涉及盐类水解和弱电解质的电离的探究,试题侧重于考查学生的实验探究能力和分析能力.

练习册系列答案
相关题目
3.25°C时,水的电离达到平衡:H2O?H++OH-,下列叙述正确的是( )
| A. | 将纯水加热到950C时,Kw变大,pH不变,水仍呈中性 | |
| B. | 向纯水中加入稀氨水,平衡逆向移动,c(OH-)增大,Kw变小 | |
| C. | 向水中加入少量固体硫酸氢钠,c(H+)增大,平衡逆向移动,KW不变 | |
| D. | 向水中通入HCl气体,平衡逆向移动,溶液导电能力减弱 |
13.用 FeCl3酸性溶液脱除 H2S 后的废液,通过控制电压电解得以再生.某同学使用石墨电极,在不同电压(x)下电解 pH=1 的 0.1mol/L FeCl2溶液,研究废液再生机理.记录如下(a、b、c代表电压值:)
(1)用 FeCl3酸性溶液脱除 H2S的离子方程式为溶液变红.
(2)Ⅰ中,Fe3+产生的原因可能是 Cl- 在阳极放电,生成的 Cl2将 Fe2+氧化.写出有关反应的方程式和电极反应式2Cl--2e-=Cl2↑、Cl2+2Fe2+=2Fe3++2Cl-.
(3)由Ⅱ推测,Fe3+产生的原因还可能是 Fe2+在阳极放电,电极反应式为
(4)Ⅱ中虽未检测出 Cl2,但 Cl- 在阳极是否放电仍需进一步验证.电解 pH=1 的 NaCl溶液做对照实验,记录如下:
①NaCl溶液的浓度是0.2mol/L.
②与Ⅱ对比,可得出的结论:AC
A.通过控制电压,验证了 Fe2+先于 Cl- 放 电
B.电压过小,Cl- 可 能 不 放 电
C. 通过控制电压,证实了产生 Fe3+的两种原因都成立
D. 通过控制电压,证实了产生 Fe3+一定仅是由于生成的 Cl2将 Fe2+氧化.
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅰ | x≥a | 电极附近出现黄色,有气泡产生 | 有Fe3+、有Cl2 |
| Ⅱ | a>x≥b | 电极附近出现黄色,无气泡产生 | 有Fe3+、无Cl2 |
| Ⅲ | b>x>0 | 无明显变化 | 无Fe3+、无Cl2 |
(2)Ⅰ中,Fe3+产生的原因可能是 Cl- 在阳极放电,生成的 Cl2将 Fe2+氧化.写出有关反应的方程式和电极反应式2Cl--2e-=Cl2↑、Cl2+2Fe2+=2Fe3++2Cl-.
(3)由Ⅱ推测,Fe3+产生的原因还可能是 Fe2+在阳极放电,电极反应式为
(4)Ⅱ中虽未检测出 Cl2,但 Cl- 在阳极是否放电仍需进一步验证.电解 pH=1 的 NaCl溶液做对照实验,记录如下:
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅳ | a>x≥c | 无明显变化 | 有Cl2 |
| Ⅴ | c>x≥b | 无明显变化 | 无Cl2 |
②与Ⅱ对比,可得出的结论:AC
A.通过控制电压,验证了 Fe2+先于 Cl- 放 电
B.电压过小,Cl- 可 能 不 放 电
C. 通过控制电压,证实了产生 Fe3+的两种原因都成立
D. 通过控制电压,证实了产生 Fe3+一定仅是由于生成的 Cl2将 Fe2+氧化.
20.下列有关离子浓度的关系不正确的是( )
| A. | 常温下,NaA溶液的pH=8,则c(Na+)-c(A-)=9.9×10-7 | |
| B. | pH=5.6的CH3COOH与CH3COONa混合溶液中,c(Na+)>(CH3COO-) | |
| C. | 0.1mol•L-1的NaHSO3的溶液中C(Na+)>C(HSO3-)>C(H+)>C(SO32-)>C(OH-) | |
| D. | 浓度均为0.1mol/L的 CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)] |
17.下列化学用语能正确表示相应意义的是( )
| A. | 乙烯的结构简式C2H4 | B. | 丁烷的结构简式CH3(CH2)2CH3 | ||
| C. | 四氯化碳的电子式 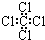 | D. | 环己烷的键线式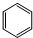 |
18.下列表述正确的是( )
| A. | c(OH-)/c(H+)=10-12的溶液中:NH4+、Cu2+、NO3-、Cl-不能大量共存 | |
| B. | 通入过量SO2气体的溶液中:HSO3-、NO3-、Ba2+不能大量共存 | |
| C. | 向足量NaHSO4溶液中逐渐滴入Ba(HCO3)2溶液的离子方程式为:HCO3-+Ba2++H++SO42-═BaSO4↓+H2O+CO2↑ | |
| D. | 向Fe(NO3)3溶液中加入HI溶液的离子方程式为:2Fe3++2I-═2Fe2++2I2 |
 某化学兴趣小组在实验室用如下装置制备氯气.
某化学兴趣小组在实验室用如下装置制备氯气.
 .
.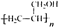 ,写出合成流程图(无机试剂任用).合成流程图示例如下:
,写出合成流程图(无机试剂任用).合成流程图示例如下: