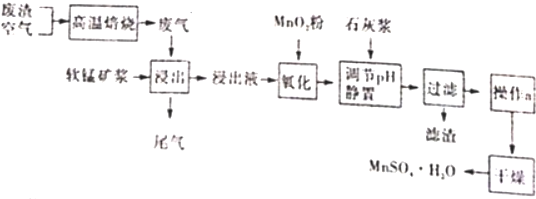
题目内容
4.有一包白色固体粉末,由CaCO3、Na2SO4、KCl、Ba(NO3)2、CuSO4 中的几种物质组成,取样品进行如下实验(假设下列过程中,能反应的物质之间的反应恰好完全):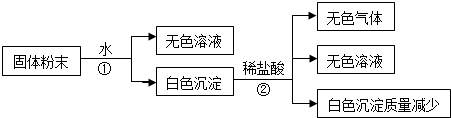
(1)步骤“①”所用分离方法叫做过滤,要从步骤②所得“无色溶液”中提取溶剂,所用分离方法叫做蒸馏.
(2)写出实验过程中发生化学反应的离子方程式Ba2++SO42-=BaSO4↓,CaCO3+2H+═Ca2++CO2↑+H2O
(3)固体粉末中一定不存在的物质是(填化学式,下同)CuSO4;一定存在的物质是CaCO3、Na2SO4、Ba(NO3)2.
(4)将固体粉末可能的组成填入下表(可以不填满,也可以再补充)
| 序号 | 化 学 式 |
| Ⅰ | |
| Ⅱ | |
| Ⅲ |
分析 根据盐的性质进行判断,在这包固体粉末由CaCO3、Na2SO4、Ba(NO3)2、CuSO4中,只有CaCO3难溶于水;取样品加水,得到无色溶液,则能排除CuSO4,因为CuSO4溶于水,显蓝色;白色的沉淀加入稀盐酸,沉淀质量减少,产生无色的气体,所以白色沉淀是硫酸钡和碳酸钙的混合物,一定含有硫酸钠和Ba(NO3)2,但是氯化钾无法判断,根据物质的性质来回答.
解答 解:(1)步骤“①”实现了固体和液体的分离,所用分离方法叫做过滤,要从步骤②所得“无色溶液”中提取溶剂,根据物质的沸点不同来进行分离的方法叫做蒸馏,故答案为:过滤;蒸馏;
(2)有一包固体粉末由CaCO3、Na2SO4、Ba(NO3)2、CuSO4中的两种物质组成,取样品加水,出现白色沉淀,该固体粉末中一定含有CaCO3,只有CaCO3是沉淀,难溶于水,且由②可知白色沉淀能与酸反应生成气体和无色溶液,沉淀质量减少,产生无色的气体,则含有有硫酸钠和硝酸钡,沉淀是硫酸钡和碳酸钙的混合物,发生的反应:Ba2++SO42-=BaSO4↓,、CaCO3+2HCl═CaCl2+CO2↑+H2O,故答案为:Ba2++SO42-=BaSO4↓,CaCO3+2H+═Ca2++CO2↑+H2O;
(3)取样品加水,出现白色沉淀,该固体粉末中一定含有CaCO3,只有CaCO3是沉淀,难溶于水,且由②可知白色沉淀能与酸反应生成气体和无色溶液,沉淀质量减少,产生无色的气体,则含有有硫酸钠和硝酸钡,沉淀是硫酸钡和碳酸钙的混合物,所以混合物中一定含有CaCO3、Na2SO4、Ba(NO3)2,一定不存在的物质是CuSO4,故答案为:CuSO4;CaCO3、Na2SO4、Ba(NO3)2;
(4)固体粉末中一定不存在的物质是硫酸铜,一定存在的物质是碳酸钙,这三种物质的组合可以是:CaCO3、Na2SO4、Ba(NO3)2或者是CaCO3、Na2SO4、Ba(NO3)2、KCl,故答案为:
| 序号 | 化学式 |
| Ⅰ | CaCO3、Na2SO4、Ba(NO3)2 |
| Ⅱ | CaCO3、Ba(NO3)2、Na2SO4、KCl |
| Ⅲ |
点评 本题考查盐的性质及鉴别,注意物质的性质以及离子检验知识的灵活应用是关键,难度中等.

 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案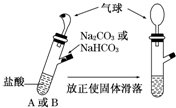
| A. | A装置的气球膨胀速度快 | |
| B. | 若最终两气球体积相同,则盐酸的浓度一定大于或等于2 mol/L | |
| C. | 若最终两气球体积不同,则盐酸的浓度一定小于或等于1 mol/L | |
| D. | 最终两试管中Na+的物质的量一定相同 |
(1)物质的量浓度相同的A、C溶液中,分别滴入甲基橙试液后,A溶液呈黄色而C中不变色;
(2)物质的量浓度相同的B、C的钠盐溶液相比较,B的钠盐溶液的pH小于C的钠盐溶液的pH;
(3)A酸和D的钠盐反应生成A的钠盐和D酸.
由此可以确定四种酸的酸性由强到弱的顺序中正确的是( )
| A. | B>C>A>D | B. | A>C>D>B | C. | D>A>C>B | D. | C>D>A>B |
①除去乙烷中少量的乙烯:光照条件下通入Cl2,气液分离
②除去乙烷中少量的乙烯:气体通过盛有酸性高锰酸钾溶液的洗气瓶
③除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤,分液、蒸馏
④除去乙醇中少量的乙酸:加足量生石灰,蒸馏.
| A. | ①② | B. | ③④ | C. | ②④ | D. | ②③ |
| A. | 向溶液中加入少许KCl固体,溶液颜色变浅 | |
| B. | 升高温度,平衡一定发生移动 | |
| C. | 加入少许KCl固体或者加入少许FeCl3固体平衡常数均发生变化,且变化方向相反 | |
| D. | 平衡常数表达式为K=$\frac{c[Fe(SCN)_{3}]•{c}^{3}(KCl)}{c(FeC{l}_{3})•{c}^{3}(KSCN)}$ |