题目内容
12.有A、B、C、D四种一元酸的溶液.实验表明:(1)物质的量浓度相同的A、C溶液中,分别滴入甲基橙试液后,A溶液呈黄色而C中不变色;
(2)物质的量浓度相同的B、C的钠盐溶液相比较,B的钠盐溶液的pH小于C的钠盐溶液的pH;
(3)A酸和D的钠盐反应生成A的钠盐和D酸.
由此可以确定四种酸的酸性由强到弱的顺序中正确的是( )
| A. | B>C>A>D | B. | A>C>D>B | C. | D>A>C>B | D. | C>D>A>B |
分析 ①物质的量浓度相同的A、C溶液中,分别滴入甲基橙试液后,A溶液呈黄色而C中不变色,说明A溶液的pH大于4.4,C溶液的pH介于3.1~4.4,则酸性C>A;
②物质的量浓度相同的钠盐溶液,酸根离子水解程度越大,钠盐溶液pH越大,则酸的酸性越弱,物质的量浓度相同的B、C的钠盐溶液相比较,B的钠盐溶液的pH小于C的钠盐溶液的pH,则C为一元弱酸,酸性B>C;
③酸A和D的钠盐反应生成A的钠盐和酸D,根据强酸能和弱酸盐反应生成弱酸知,酸性A>D,
据此判断四种酸的酸性强弱.
解答 解:由①知A溶液的pH大于4.4,C溶液的pH介于3.1~4.4,说明C的酸性比A的酸性强;
由②知B的酸性比C的酸性强,因酸越弱,其钠盐水解的程度越大,所得溶液的pH越大,所以酸性B>C;
由“较强酸+较弱酸的盐反应能生成较强酸的盐+较弱的酸”的规律可知,A的酸性比D的酸性强,所以酸性酸性A>D,
即酸性强弱顺序为:B>C>A>D,
故选A.
点评 本题以弱电解质电离为载体考查酸性强弱判断,明确酸的电离程度与酸根离子水解程度关系、强酸制取弱酸原理即可解答,熟练掌握弱电解质电离特点,题目难度不大.

练习册系列答案
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目
2.下列说法正确的是( )
| A. | KClO3和SO3溶于水后能导电,故KClO3和SO3为电解质 | |
| B. | 25℃时、用醋酸溶液滴定等浓度NaOH溶液至pH=7,V醋酸>VNaOH | |
| C. | 在蒸馏水中滴加浓H2SO4,KW不变 | |
| D. | NaCl 溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 |
20.在容积不变的密闭容器中进行如下反应:N2+3H2?2NH3,若将平衡体系中各物质的浓度都增加到原来的2倍,下列说法错误的是( )
| A. | NH3的质量分数将增加 | B. | 平衡向正反应方向移动 | ||
| C. | 平衡向逆反应方向移动 | D. | 正逆反应速率都增大 |
17.将少量金属钠投入下列稀溶液中,溶液质量减少的是( )
| A. | NaCl | B. | NaOH | C. | NH4NO3 | D. | Ca(HCO3)2 |
4.有一包白色固体粉末,由CaCO3、Na2SO4、KCl、Ba(NO3)2、CuSO4 中的几种物质组成,取样品进行如下实验(假设下列过程中,能反应的物质之间的反应恰好完全):
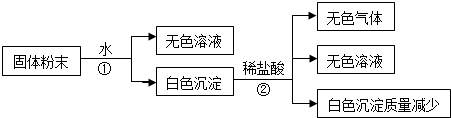
(1)步骤“①”所用分离方法叫做过滤,要从步骤②所得“无色溶液”中提取溶剂,所用分离方法叫做蒸馏.
(2)写出实验过程中发生化学反应的离子方程式Ba2++SO42-=BaSO4↓,CaCO3+2H+═Ca2++CO2↑+H2O
(3)固体粉末中一定不存在的物质是(填化学式,下同)CuSO4;一定存在的物质是CaCO3、Na2SO4、Ba(NO3)2.
(4)将固体粉末可能的组成填入下表(可以不填满,也可以再补充)
(5)设计一个实验,进一步确定混合物的组成,简述实验操作、现象和结论用试管取少许步骤①中的“无色溶液”,滴入HNO3酸化,再滴入AgNO3溶液.若有白色沉淀出现,则原白色固体粉末中含有KCl;若无白色沉淀出现,则原白色固体粉末中不含KCl.

(1)步骤“①”所用分离方法叫做过滤,要从步骤②所得“无色溶液”中提取溶剂,所用分离方法叫做蒸馏.
(2)写出实验过程中发生化学反应的离子方程式Ba2++SO42-=BaSO4↓,CaCO3+2H+═Ca2++CO2↑+H2O
(3)固体粉末中一定不存在的物质是(填化学式,下同)CuSO4;一定存在的物质是CaCO3、Na2SO4、Ba(NO3)2.
(4)将固体粉末可能的组成填入下表(可以不填满,也可以再补充)
| 序号 | 化 学 式 |
| Ⅰ | |
| Ⅱ | |
| Ⅲ |
1.对于反应3Cl2+6NaOH═5NaCl+NaClO3+3H2O,以下叙述正确的是( )
| A. | Cl2是氧化剂,NaOH是还原剂 | |
| B. | 被氧化的Cl原子和被还原的Cl原子的物质的量的比为5:1 | |
| C. | 每生成1mol的NaClO3转移6mol的电子 | |
| D. | Cl2既是氧化剂又是还原剂 |