题目内容
13.我国近代化学的启蒙者徐寿在他翻译的化学书籍中,称一种气体为“养气”,该气体在空气中约占总体积的五分之一.请回答:(1)“养气”的化学式O2;
(2)“养气”的一种用途供给呼吸(或支持燃烧等).
分析 根据题意,“养气”在空气中约占总体积的五分之一,结合空气的组成、该气体的用途进行分析解答.
解答 解:(1)根据题意,“养气”在空气中约占总体积的五分之一,空气的成分按体积计算,大约是:氮气占78%(约占五分之四)、氧气占21%(约占五分之一),故“养气”就是氧气,其化学式为O2.故答案为:O2;
(2)氧气能供给呼吸或支持燃烧等.
故答案为:供给呼吸(或支持燃烧等).
点评 本题难度不大,熟记空气的成分及各成分的体积分数、掌握氧气的用途是解答本题的关键.

练习册系列答案
相关题目
4.有一包白色固体粉末,由CaCO3、Na2SO4、KCl、Ba(NO3)2、CuSO4 中的几种物质组成,取样品进行如下实验(假设下列过程中,能反应的物质之间的反应恰好完全):
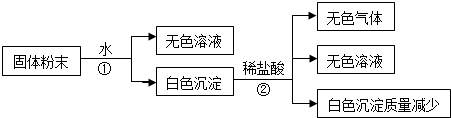
(1)步骤“①”所用分离方法叫做过滤,要从步骤②所得“无色溶液”中提取溶剂,所用分离方法叫做蒸馏.
(2)写出实验过程中发生化学反应的离子方程式Ba2++SO42-=BaSO4↓,CaCO3+2H+═Ca2++CO2↑+H2O
(3)固体粉末中一定不存在的物质是(填化学式,下同)CuSO4;一定存在的物质是CaCO3、Na2SO4、Ba(NO3)2.
(4)将固体粉末可能的组成填入下表(可以不填满,也可以再补充)
(5)设计一个实验,进一步确定混合物的组成,简述实验操作、现象和结论用试管取少许步骤①中的“无色溶液”,滴入HNO3酸化,再滴入AgNO3溶液.若有白色沉淀出现,则原白色固体粉末中含有KCl;若无白色沉淀出现,则原白色固体粉末中不含KCl.

(1)步骤“①”所用分离方法叫做过滤,要从步骤②所得“无色溶液”中提取溶剂,所用分离方法叫做蒸馏.
(2)写出实验过程中发生化学反应的离子方程式Ba2++SO42-=BaSO4↓,CaCO3+2H+═Ca2++CO2↑+H2O
(3)固体粉末中一定不存在的物质是(填化学式,下同)CuSO4;一定存在的物质是CaCO3、Na2SO4、Ba(NO3)2.
(4)将固体粉末可能的组成填入下表(可以不填满,也可以再补充)
| 序号 | 化 学 式 |
| Ⅰ | |
| Ⅱ | |
| Ⅲ |
5.下列各溶液中,Na+浓度最大的是( )
| A. | 0.5L1.2mol•L-1的Na2SO4溶液 | B. | 2L 0.8mol•L-1的Na0H溶液 | ||
| C. | 1L1mol•L-1的Na2CO3溶液 | D. | 4L 0.5mol•L-1的NaCl溶液 |
18.分子式为 C5H12O 的醇与和它相对分子质量相等的一元羧酸进行酯化反应,生成的酯共有(不考虑立体异构)( )
| A. | 15 种 | B. | 16 种 | C. | 17 种 | D. | 18 种 |
2.设NA表示阿伏加德罗常数.下列说法中错误的是( )
| A. | 标准状况下,22.4 L由H2和O2组成的混合气体,所含分子总数为NA | |
| B. | 1mol Cl2参加反应,转移的电子数一定为2NA | |
| C. | 常温常压下,1 mol氖气含有的原子数为NA | |
| D. | 1L1 mol.L-l FeCl3溶液中Fe3+的数目小于NA |
3.若某溶液中有Fe2+和I-共存,要氧化I-而又不氧化Fe2+,可加入的试剂是( )
| A. | Cl2 | B. | KMnO4 | C. | HCl | D. | FeCl3 |