题目内容
16.(1)第三代混合动力车,可以用电动机、内燃机或二者结合推动车辆.汽车上坡或加速时,电动机提供推动力,降低汽油的消耗;在刹车或下坡时,电池处于充电状态.混合动力车目前一般使用镍氢电池,该电池中镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解质溶液.镍氢电池充放电原理如图1所示,其总反应式为H2+2NiOOH$?_{充电}^{放电}$2Ni(OH)2.根据所给信息判断,混合动力车刹车或下坡时,乙电极周围溶液的pH减小(填“增大”、“减小”或“不变”),该电极的电极反应式为:Ni(OH)2+OH--e-═NiOOH+H2O.(2)图2是一种新型燃料电池,以CO为燃料,一定比例的Li2CO3和Na2CO3的熔融混合物为电解质,图3是粗铜精炼的装置图,现用燃料电池为电源进行粗铜的精炼实验.
回答下列问题:
①A极为电源负极(填“正”或“负”)极,写出A极的电极反应式:CO-2e-+CO32-=2CO2.
②要用燃料电池为电源进行粗铜的精炼实验,则B极应该与D极(填“C”或“D”)相连.
③当消耗标准状况下2.24L CO时,C电极的质量变化为6.4g.
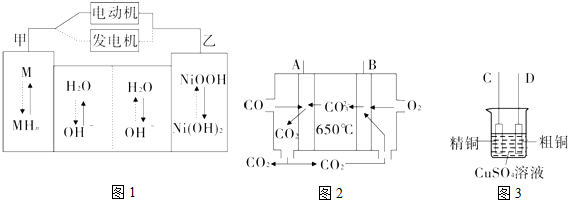
分析 (1)混合动力车刹车或下坡时,是电解池工作原理,乙电极为阳极,是2Ni(OH)2转化为NiOOH的过程,乙电极周围因氢氧根离子的浓度减小,pH将减小;
(2)①根据CO具有还原性,在负极上发生氧化反应生成CO2,结合电解质书写电极反应式;
②根据A为负极,B为正极,粗铜精炼时,粗铜作阳极,与电源的正极相连;
③根据电子得失守恒以及精铜中铜离子得到电子来计算.
解答 解:(1)混合动力车刹车或下坡时,是电解池工作原理,乙电极为阳极,是2Ni(OH)2转化为NiOOH的过程,电极方程式为Ni(OH)2+OH--e-═NiOOH+H2O,乙电极周围因氢氧根离子的浓度减小,pH将减小,
故答案为:减小;Ni(OH)2+OH--e-═NiOOH+H2O;
(2)①CO具有还原性,在负极上发生氧化反应生成CO2,电极反应式为:CO-2e-+CO32-═2CO2,
故答案为:负极;CO-2e-+CO32-=2CO2;
②因A为负极,B为正极,粗铜精炼时,粗铜作阳极,与电源的正极相连,故选:D;
③当消耗标准状况下2.24L CO时,电极反应式:CO-2e-+CO32-=2CO2,失去电子为$\frac{2.24L}{22.4L/mol}$×2=0.1mol,精铜电极电极反应式:Cu2++2e-=Cu,由电子得失守恒可知Cu2+的物质的量为$\frac{0.2mol}{2}$=0.1mol,精铜电极的质量增加的质量为:0.1mol×64g/mol=6.4g,
故答案:6.4.
点评 本题考查原电池和电解池的工作原理等知识点,综合性较强,侧重考查学生分析计算能力,难点是电极反应式的书写,要根据电解质确定电极反应式书写方式,题目难度不大.

练习册系列答案
相关题目
4.有一包白色固体粉末,由CaCO3、Na2SO4、KCl、Ba(NO3)2、CuSO4 中的几种物质组成,取样品进行如下实验(假设下列过程中,能反应的物质之间的反应恰好完全):
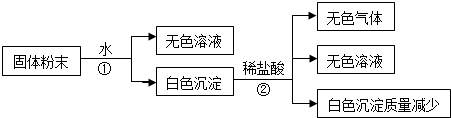
(1)步骤“①”所用分离方法叫做过滤,要从步骤②所得“无色溶液”中提取溶剂,所用分离方法叫做蒸馏.
(2)写出实验过程中发生化学反应的离子方程式Ba2++SO42-=BaSO4↓,CaCO3+2H+═Ca2++CO2↑+H2O
(3)固体粉末中一定不存在的物质是(填化学式,下同)CuSO4;一定存在的物质是CaCO3、Na2SO4、Ba(NO3)2.
(4)将固体粉末可能的组成填入下表(可以不填满,也可以再补充)
(5)设计一个实验,进一步确定混合物的组成,简述实验操作、现象和结论用试管取少许步骤①中的“无色溶液”,滴入HNO3酸化,再滴入AgNO3溶液.若有白色沉淀出现,则原白色固体粉末中含有KCl;若无白色沉淀出现,则原白色固体粉末中不含KCl.

(1)步骤“①”所用分离方法叫做过滤,要从步骤②所得“无色溶液”中提取溶剂,所用分离方法叫做蒸馏.
(2)写出实验过程中发生化学反应的离子方程式Ba2++SO42-=BaSO4↓,CaCO3+2H+═Ca2++CO2↑+H2O
(3)固体粉末中一定不存在的物质是(填化学式,下同)CuSO4;一定存在的物质是CaCO3、Na2SO4、Ba(NO3)2.
(4)将固体粉末可能的组成填入下表(可以不填满,也可以再补充)
| 序号 | 化 学 式 |
| Ⅰ | |
| Ⅱ | |
| Ⅲ |
1.对于反应3Cl2+6NaOH═5NaCl+NaClO3+3H2O,以下叙述正确的是( )
| A. | Cl2是氧化剂,NaOH是还原剂 | |
| B. | 被氧化的Cl原子和被还原的Cl原子的物质的量的比为5:1 | |
| C. | 每生成1mol的NaClO3转移6mol的电子 | |
| D. | Cl2既是氧化剂又是还原剂 |
8.下列有关晶体的叙述中正确的是( )
| A. | 冰熔化时水分子中共价键发生断裂 | |
| B. | 原子晶体中只存在共价键,一定不含有离子键 | |
| C. | 金属晶体的熔沸点均很高 | |
| D. | 分子晶体中一定含有共价键 |
5.下列各溶液中,Na+浓度最大的是( )
| A. | 0.5L1.2mol•L-1的Na2SO4溶液 | B. | 2L 0.8mol•L-1的Na0H溶液 | ||
| C. | 1L1mol•L-1的Na2CO3溶液 | D. | 4L 0.5mol•L-1的NaCl溶液 |
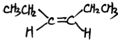
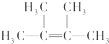 ;名称是2,3-二甲基-2-丁烯.
;名称是2,3-二甲基-2-丁烯.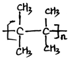 .
. 或(CH3CH2)2C=CH2.
或(CH3CH2)2C=CH2.
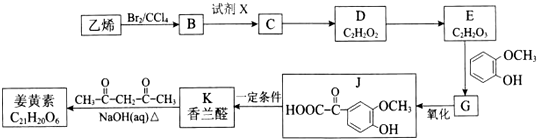
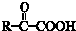 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$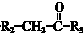
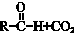 $→_{△}^{NaOH(ap)}$R1-
$→_{△}^{NaOH(ap)}$R1-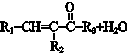
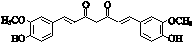 .
.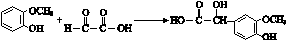 ;其反应类型是加成反应.
;其反应类型是加成反应.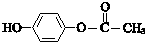 .
.