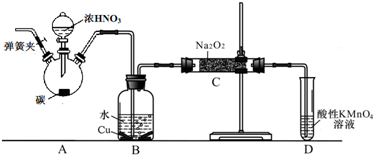
题目内容
14.高温焙烧含硫废渣会产生SO2废气,为了回收利用SO2,研究人员研制了利用低品位软锰矿浆(主要成分是MnO2)吸收SO2并制备硫酸猛晶体的生产流程,其流程示意图如下: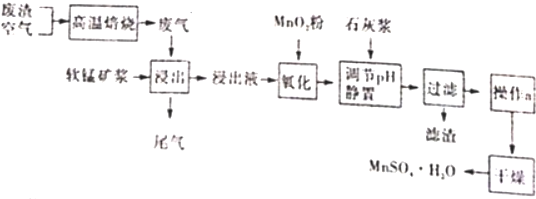
已知:浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+等其他金属离子.
请回答下列问题:
(1)高温焙烧在实验室宜选择的主要仪器是坩埚
(2)26.lg低品位软锰矿吸收了含20.0%SO2的废气2.24L(标况下),则低品位软锰矿浆含MnO2的质量分数为6.67%
(3)二氧化锰除能将SO2氧化外,在图中“氧化”过程还能将Fe2+氧化(填离子符号)
(4)滤渣的主要成分有氢氧化铁、氢氧化铝、硫酸钙
(5)工业生产中为了确定需要向浸出液中加入多少MnO2粉,可准确量取10.00mL浸出液用0.02mol/L酸性KMnO4溶液滴定,判断滴定终点的方法是当滴入最后一滴酸性KMnO4溶液,溶液变紫红色,且半分钟内不褪色,若达滴定终点共消耗10.00mL酸性KMnO4溶液,请计算浸出液中Fe2+浓度是0.1mol/L.
(6)操作a的具体过程蒸发浓缩、冷却结晶、过滤洗涤.
分析 高温焙烧含硫废渣产生的SO2废气,软锰矿浆的主要成分是MnO2,通入SO2浸出液的pH<2,其中的金属离子主要是Mn2+,则MnO2与SO2发生氧化还原反应,浸出液还含有少量的Fe2+、Al3+等其他金属离子,Fe2+具有还原性,可以被MnO2在酸性条件下氧化成Fe3+,在氧化后的液体中加入石灰浆,杂质中含有Fe2+、Al3+、Ca2+等阳离子,由沉淀的pH范围知,Fe2+的沉淀与Mn2+离子的沉淀所需的pH接近,而Fe3+则相差很远,故可以将Fe2+氧化成Fe3+而除杂.调节pH值在4.7~8.3间,Fe3+、Al3+阳离子通过调pH值,转化为氢氧化铁、氢氧化铝沉淀,同时生成微溶的硫酸钙,过滤,滤渣主要有氢氧化铁、氢氧化铝、硫酸钙,由于制取的MnSO4•H2O含有结晶水,故操作a采用蒸发浓缩结晶的方法,得到MnSO4•H2O.
(1)加热固体,应在坩埚中进行;
(2)反应的化学方程式为SO2+MnO2=MnSO4,根据方程式计算;
(3)杂质离子中只有Fe2+具有还原性,可以被MnO2在酸性条件下氧化成Fe3+;
(4)Fe3+、Al3+阳离子通过调pH值,转化为氢氧化铁、氢氧化铝沉淀,同时生成微溶的硫酸钙;
(5)高锰酸钾有颜色,滴定终点时溶液变为紫红色,结合电子转移的数目计算;
(6)由滤液得到晶体,应进行蒸发浓缩、冷却结晶、过滤洗涤等操作.
解答 解:高温焙烧含硫废渣产生的SO2废气,软锰矿浆的主要成分是MnO2,通入SO2浸出液的pH<2,其中的金属离子主要是Mn2+,则MnO2与SO2发生氧化还原反应,浸出液还含有少量的Fe2+、Al3+等其他金属离子,Fe2+具有还原性,可以被MnO2在酸性条件下氧化成Fe3+,在氧化后的液体中加入石灰浆,杂质中含有Fe2+、Al3+、Ca2+等阳离子,由沉淀的pH范围知,Fe2+的沉淀与Mn2+离子的沉淀所需的pH接近,而Fe3+则相差很远,故可以将Fe2+氧化成Fe3+而除杂.调节pH值在4.7~8.3间,Fe3+、Al3+阳离子通过调pH值,转化为氢氧化铁、氢氧化铝沉淀,同时生成微溶的硫酸钙,过滤,滤渣主要有氢氧化铁、氢氧化铝、硫酸钙,由于制取的MnSO4•H2O含有结晶水,故操作a采用蒸发浓缩结晶的方法,得到MnSO4•H2O.
(1)加热固体,应在坩埚中进行,故答案为:坩埚;
(2)低品位软锰矿浆的主要成分是MnO2,通入SO2浸出液的pH<2,其中的金属离子主要是Mn2+,则MnO2与SO2发生氧化还原反应,反应的化学方程式为SO2+MnO2=MnSO4,n(SO2)=$\frac{2.24L×20%}{22.4L/mol}$=0.02mol,则n(MnO2)=0.02mol,m(MnO2)=0.02mol×87g/mol=1.74g,ω(MnO2)=$\frac{1.74g}{26.1g}×100%$=6.67%,
故答案为:6.67%;
(3)由以上分析可知,二氧化锰除能将SO2氧化外,在图中“氧化”过程还能将 Fe2+氧化,故答案为:Fe2+;
(4)Fe3+、Al3+阳离子通过调pH值,转化为氢氧化铁、氢氧化铝沉淀,同时生成微溶的硫酸钙,所以滤渣主要有氢氧化铁、氢氧化铝、硫酸钙,
故答案为:氢氧化铁、氢氧化铝、硫酸钙;
(5)高锰酸钾有颜色,滴定终点时溶液变为紫红色,判断方法为当滴入最后一滴酸性KMnO4溶液,溶液变紫红色,且半分钟内不褪色,若达滴定终点共消耗l0.00mL酸性KMnO4溶液,则n(KMnO4)=0.01L×0.02mol/L=2×10-4mol,得电子的物质的量为2×10-4mol×(7-2)=10-3mol,反应中Fe2+被氧化生成Fe3+,则
n(Fe2+)=10-3mol,c(Fe2+)=$\frac{0.001mol}{0.01L}$=0.1 mol/L
故答案为:当滴入最后一滴酸性KMnO4溶液,溶液变紫红色,且半分钟内不褪色;0.1 mol/L;
(6)由滤液得到晶体,应进行蒸发浓缩、冷却结晶、过滤洗涤等操作,故答案为:蒸发浓缩、冷却结晶、过滤洗涤.
点评 本题以制备硫酸锰的生产流程为知识载体,综合考查学生的分析能力、实验能力和计算能力,为高频考点,涉及考查化学反应的书写,及除杂中的问题,题目难度中等,本题注意把握数据处理能力和图象分析能力.

| A. | 钠质软,可用小刀切割 | |
| B. | 钠要保存在煤油或者石蜡油中 | |
| C. | 钠着火可用干沙扑灭 | |
| D. | 钠与氧气反应,产物是由氧气的量决定的 |
| A. | Pb2++2CH3COO-+2H++S2-═PbS↓+2CH3COOH | |
| B. | Pb2++H2S═PbS↓+2H+ | |
| C. | Pb2++2CH3COO-+H2S═PbS↓+2CH3COOH | |
| D. | (CH3COO)2Pb+H2S═PbS↓+2CH3COOH |
| A. | KClO3和SO3溶于水后能导电,故KClO3和SO3为电解质 | |
| B. | 25℃时、用醋酸溶液滴定等浓度NaOH溶液至pH=7,V醋酸>VNaOH | |
| C. | 在蒸馏水中滴加浓H2SO4,KW不变 | |
| D. | NaCl 溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 |
| A. | 澄清透明的溶液:Cu2+、SO42-、Mg2+、Cl- | |
| B. | 1.Omol•L-1的HNO3溶液:K+、Fe2+、Cl-、SO42- | |
| C. | 1.Omol•L-1 的KI溶液:Na+、Fe3+、Cl-、SO42- | |
| D. | l.Omo•L-1的 CaCl2溶液:Na+、K+、Cl-、CO32- |
| A. | 金属钠投入到Na2SO4溶液中 | B. | BaCl2和NaHSO4溶液反应 | ||
| C. | 小苏打溶液和澄清石灰水反应 | D. | Na2O2和CuSO4溶液反应 |
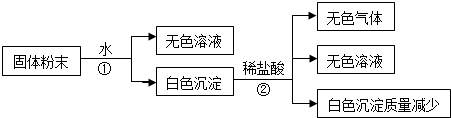
(1)步骤“①”所用分离方法叫做过滤,要从步骤②所得“无色溶液”中提取溶剂,所用分离方法叫做蒸馏.
(2)写出实验过程中发生化学反应的离子方程式Ba2++SO42-=BaSO4↓,CaCO3+2H+═Ca2++CO2↑+H2O
(3)固体粉末中一定不存在的物质是(填化学式,下同)CuSO4;一定存在的物质是CaCO3、Na2SO4、Ba(NO3)2.
(4)将固体粉末可能的组成填入下表(可以不填满,也可以再补充)
| 序号 | 化 学 式 |
| Ⅰ | |
| Ⅱ | |
| Ⅲ |
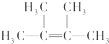 ;名称是2,3-二甲基-2-丁烯.
;名称是2,3-二甲基-2-丁烯.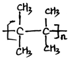 .
. 或(CH3CH2)2C=CH2.
或(CH3CH2)2C=CH2.