题目内容
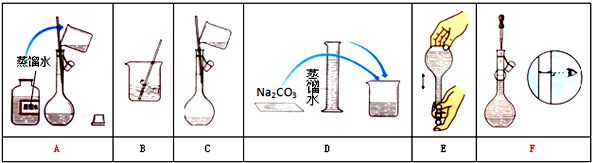
9.实验室配制1000mL1mol/LNaCl溶液,请完成以下步骤:(1)计算:需要称量58.5克NaCl固体
(2)称量:用托盘天平称量所需固体.
(3)溶解:将称量好的NaCl固体倒入烧杯中加水溶解,并恢复到室温.
(4)转移:将烧杯中的溶液用玻璃棒引流转移入1000mL容量瓶中.
(5)洗涤:用蒸馏水洗涤烧杯和玻璃棒2~3次,并将洗涤液全部转移入容量瓶 中如果没有将洗涤液转移人容量瓶,所配溶液的浓度将偏小(填偏大或偏小)
(6)旋摇:轻轻旋摇容量瓶,使溶液混合均匀
(7)定容:向容量瓶中加水至距离刻度线1~2厘米处,改用胶头滴管滴
加水至溶液凹液面与刻度线相切.
(8)摇匀:上下颠倒摇匀,使溶液混合均匀
(9)装瓶贴签:将配制好的溶液转移到试剂瓶中,贴上标签.
分析 (1)依据m=CVM计算需要溶质的质量;
(2)称量固体用托盘天平;
(4)溶液配制是在容量瓶中进行,依据配制溶液体积选择容量瓶规格;
(5)如果没有将洗涤液转移人容量瓶,导致部分溶质损失,溶质的物质的量偏小,依据C=$\frac{n}{V}$进行误差分析;
(7)依据定容的正确操作解答.
解答 解:(1)室配制1000mL1mol/LNaCl溶液,需要氯化钠质量m=1mol/L×1L×58.5g=58.5g;
故答案为:58.5;
(2)称量固体用托盘天平;
故答案为:托盘天平;
(4)配制1000mL1mol/LNaCl溶液,应选择1000mL容量瓶;
故答案为:1000;
(5)如果没有将洗涤液转移人容量瓶,导致部分溶质损失,溶质的物质的量偏小,依据C=$\frac{n}{V}$可知,所配溶液浓度偏小;
故答案为:偏小;
(7)定时时,直接向容量瓶中加入蒸馏水到离刻度线1-2cm改用胶头滴管逐滴滴加到凹液面最低处与刻度线相切;
故答案为:胶头滴管.
点评 本题考查了一定物质的量浓度溶液的配制,侧重考查配制步骤,明确配制原理及操作步骤即可解答,题目难度不大.

练习册系列答案
相关题目
某市对大气进行监测,发现首要污染物为可吸入颗粒物PM2.5,其主要来源为燃煤、机动车尾气等。将PM2.5样本用蒸馏水处理制成溶液,该溶液中所含水溶性无机离子的浓度如下表:
离子 | K+ | Na+ | NH4+ | H + | SO42- | NO3- | Cl- |
浓度/mol·L-1 | 4×10-6 | 6×10-6[ | 2×10-5 | x | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据判断H+ 的浓度为 mol·L-1
A.1×10-5 mol·L-1 B.3×10-5 mol·L-1
C.6×10-5 mol·L-1 D.1×10-4mol·L-1
4. 某研究小组用标准NaOH溶液滴定白醋,测定食用白醋中醋酸的含量.下列说法正确的是( )
某研究小组用标准NaOH溶液滴定白醋,测定食用白醋中醋酸的含量.下列说法正确的是( )
 某研究小组用标准NaOH溶液滴定白醋,测定食用白醋中醋酸的含量.下列说法正确的是( )
某研究小组用标准NaOH溶液滴定白醋,测定食用白醋中醋酸的含量.下列说法正确的是( )| A. | 用如图乙量取一定体积的待测白醋放入锥形瓶中 | |
| B. | 观察碱式滴定管读数时,若滴定前仰视,滴定后俯视,则结果会导致食用白醋中醋酸的含量偏小 | |
| C. | 碱式滴定管尖嘴部分有气泡,滴定后消失,则结果会导致食用白醋中醋酸的含量偏大 | |
| D. | 滴定时眼睛要注视着滴定管内NaOH溶液的液面变化,防止滴定过量 |
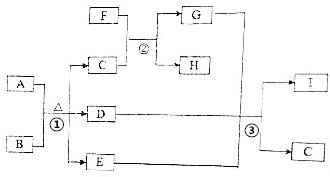 有关物质的转化关系如图所示(部分生成物与反应条件己略去).A是常见的非金属固体单质,F是紫红色的金属单质,B、C是常见的强酸,D、G、I是常见的气体,D与I的组成元素相同,且D的相对分子质量比I的大16.E是最常见的无色液体.请回答下列问题:
有关物质的转化关系如图所示(部分生成物与反应条件己略去).A是常见的非金属固体单质,F是紫红色的金属单质,B、C是常见的强酸,D、G、I是常见的气体,D与I的组成元素相同,且D的相对分子质量比I的大16.E是最常见的无色液体.请回答下列问题: .
. )
) 2C(g)。2 s内的反应速率:v(A2)=0.5 mol·L-1·s-1,v(B2)=1.5 mol·L-1·s-1,v(C)=1 mol·L-1·s-1。则x和y的值分别为
2C(g)。2 s内的反应速率:v(A2)=0.5 mol·L-1·s-1,v(B2)=1.5 mol·L-1·s-1,v(C)=1 mol·L-1·s-1。则x和y的值分别为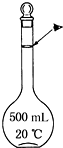 实验室配制500mL 0.5mol•L-1的NaCl溶液,有如下操作步骤:
实验室配制500mL 0.5mol•L-1的NaCl溶液,有如下操作步骤: