题目内容
17.6g某单质X能从盐酸中置换出0.3gH2,同时生成XCl2,另一种元素Y,它的最高价氧化物的化学式为YO3,在Y的氰化物中,Y的质量分数为94.1%.(1)X、Y叫元豕的相对原子质量:X40Y32
(2)写出Y的另一种常见氧化物与足量X的最高价氧化物对应水化物反应的化学方程式SO2+Ca(OH)2=CaSO3+H2O.
分析 X与盐酸发生反应:X+2HCl=ACl2+H2↑,根据方程式计算X的相对原子质量;Y的最高价氧化物的化学式为YO3,则其氢氧化物为H2Y,结合氢化物中Y的质量分数计算Y的相对原子质量,根据相对原子质量确定元素,由此分析解答.
解答 解:(1)设X、Y的相对原子质量分别为MX、MY,则有:
X+2HCl=XCl2+H2↑
MXg 2g
6g 0.3g
所以MXg:6g=2g:0.3g,解得MX=40,故X为Ca,
据题意可知,Y的氢化物的化学式为H2Y,故有2:MY=(1-94.1%):94.1%,解得MY≈32,故Y为S,
故答案为:40、32;
(2)Y的另一种常见氧化物与足量X的最高价氧化物对应水化物反应的化学方程式:SO2+Ca(OH)2=CaSO3+H2O,故答案为:SO2+Ca(OH)2=CaSO3+H2O.
点评 本题考查元素推断、元素化合物性质、化学方程式的书写,关键是计算推断元素,注意二氧化硫是酸性氧化物,与碱反应生成盐与水.

练习册系列答案
相关题目
7.下列实验操作、实验现象以及实验结论完全正确的是( )
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | 植物油中加入含有酚酞的NaOH溶液,微热 | 红色变浅,且不再分层 | 油脂发生了水解反应 |
| B | 柠檬醛( )中加入酸性高锰酸钾溶液 )中加入酸性高锰酸钾溶液 | 溶液褪色 | 柠檬醛分子中含有醛基 |
| C | 溴乙烷与NaOH溶液共热后,加入AgNO3溶液 | 出现淡黄色沉淀 | 溴乙烷发生了水解 |
| D | 向含H2SO4的淀粉水解液中加入新制的Cu(OH)2悬浊液,煮沸 | 没有砖红色沉淀 | 淀粉未水解 |
| A. | A | B. | B | C. | C | D. | D |
12.下列叙述错误的是( )
| A. | 蚕丝、羊毛、棉花的主要成分都是蛋白质 | |
| B. | 纤维素、油脂、蛋白质都能水解,但水解产物不同 | |
| C. | 油脂在碱的催化作用下可发生水解,工业上利用该反应生产肥皂 | |
| D. | 乙酸乙酯中的少量乙酸可用饱和Na2CO3溶液除去 |
9.下列说法中正确的是( )
| A. | 石油的分馏和煤的干馏都是物理变化 | |
| B. | 油脂、淀粉、纤维素都是高分子化合物 | |
| C. | 酯类物质是形成水果香味的主要成分 | |
| D. | 纤维素和淀粉互为同分异构体 |
10.如图所示的装置中,属于原电池的是( )
| A. | 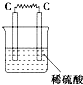 | B. | 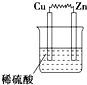 | C. | 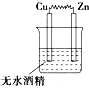 | D. | 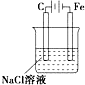  |
 ,W与R形成的化合物的化学式为Na3N.它们的晶体属于离子晶体.
,W与R形成的化合物的化学式为Na3N.它们的晶体属于离子晶体.