题目内容
2.将10.6g Na2CO3溶于水配成1L溶液.(1)该溶液中Na2CO3的物质的量浓度为多少?
(2)溶液Na+的物质的量浓度为多少?
(可能用到的相对原子质量Na 23,C 12,O 16,)
分析 (1)根据n=$\frac{m}{M}$计算碳酸钠物质的量,再根据c=$\frac{n}{V}$计算c(Na2CO3);
(2)溶液中c(Na+)=2c(Na2CO3)来计算溶液Na+的物质的量浓度;
解答 解::(1)碳酸钠物质的量=$\frac{10.6g}{106g/mol}$=0.1mol,故溶液中c(Na2CO3)=$\frac{0.1mol}{1L}$=0.1mol/L,答:该溶液中Na2CO3的物质的量浓度为0.1mol/L;
(2)溶液中c(Na+)=2c(Na2CO3)=0.1mol/L×2=0.2mol/L,答:液Na+的物质的量浓度为0.2mol/L.
点评 本题考查物质的量浓度有关计算,比较基础,注意对公式的理解与灵活应用.

练习册系列答案
相关题目
13.下列反应不属于四个基本反应类型,但属于氧化还原反应的是( )
| A. | Fe+CuSO4=FeSO4+Cu | B. | Cl2+H2O=HCl+HClO | ||
| C. | 2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑ | D. | AgNO3+HCl=AgCl↓+HNO3 |
10.(1)在1×105Pa和298K时,将1mol气态AB分子分离成气态A原子和B原子所需要的能量成为键能(kJ•mol-1).下面是一些共价键的键能:(已知氨分子中有三个等价的氮氢共价键)
根据表中的数据判断工业合成氨的反应是放热(填“吸热”或“放热”)反应; 在298K时,取1mol氮气和3mol氢气放入一密闭容器中,在催化剂存在下进行反应.可生成0.4mol氨气,则放出(或吸收)的热量为18.6KJ.
(2)下列变化:①碘的升华 ②烧碱熔化 ③氯化钠溶于水 ④氯化氢溶于水
⑤氧气溶于水 ⑥氯化铵受热分解.(本题只填序号)
未发生化学键破坏的是①⑤;仅发生离子键破坏的是②③;
仅发生共价键破坏的是④;既发生离子键又发生共价键破坏的是⑥.
(3)由A、B、C、D四种金属按下表中装置进行实验,根据实验现象得出A、B、C、D四种金属的活泼性由强到弱的顺序为D>A>B>C.
(4)若氢气的燃烧过程中,破坏1molH2中的化学键消耗的能量为Q1kJ,破坏1molO2
中的化学键为Q2kJ,形成1molH2O中的化学键释放的能量为Q3.下列关系式正确的是D
A、Q1+Q2>Q3 B、Q1+Q2<Q3
C、2Q1+Q2>2Q3 D、2Q1+Q2<2Q3.
| 共价键 | H-H | N≡N | H-N |
| 键能(kJ•mol-1) | 436 | 945 | 391 |
(2)下列变化:①碘的升华 ②烧碱熔化 ③氯化钠溶于水 ④氯化氢溶于水
⑤氧气溶于水 ⑥氯化铵受热分解.(本题只填序号)
未发生化学键破坏的是①⑤;仅发生离子键破坏的是②③;
仅发生共价键破坏的是④;既发生离子键又发生共价键破坏的是⑥.
(3)由A、B、C、D四种金属按下表中装置进行实验,根据实验现象得出A、B、C、D四种金属的活泼性由强到弱的顺序为D>A>B>C.
| 装置 | 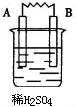 | 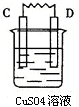 | 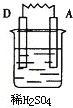 | 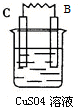 |
| 现象 | 金属A不断溶解 | C的质量增加 | A上有气体产生 | 金属B不断溶解 |
中的化学键为Q2kJ,形成1molH2O中的化学键释放的能量为Q3.下列关系式正确的是D
A、Q1+Q2>Q3 B、Q1+Q2<Q3
C、2Q1+Q2>2Q3 D、2Q1+Q2<2Q3.
7.按要求写出下列物质对应的式子(画了斜线的空格不写)
| 名称 | 分子式 | 结构式 | 结构简式 |
| 乙烯 | C2H4 |  | \ |
| 丙烯 | C3H6 | \ | CH3-CH=CH2 |
| 乙炔 | \ | H-C≡C-H | |
| 异丁烷 | \ | CH3CH(CH3)CH3 |
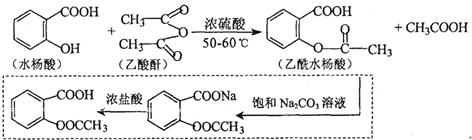
 .
. .
.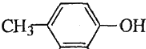 也能与乙酸酐发生类似反应,请写出化学反应方程式,可不写条件:
也能与乙酸酐发生类似反应,请写出化学反应方程式,可不写条件: .
.

 .
. .化合物
.化合物 是合成药物的中间体,请写出以有机物A和
是合成药物的中间体,请写出以有机物A和 为原料制备该化合物的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
为原料制备该化合物的合成路线流程图(无机试剂任用).合成路线流程图示例如下: