题目内容
9.常温下,将pH=11的氨水与pH=3的盐酸等体积混合,充分反应后溶液的pH( )| A. | 小于7 | B. | 等于7 | C. | 大于7 | D. | 无法判断 |
分析 根据两种溶液中H+和OH-的关系以及氨水为弱电解质的性质,判断反应后酸碱的过量,进而判断反应后溶液的酸碱性.
解答 解:pH=3的盐酸中c(H+)=10-3mol/L,pH=11的氨水中c(OH-)=10-3mol/L,两种溶液H+与OH-离子浓度相等,但由于氨水为弱电解质,不能完全电离,则氨水浓度大于10-3mol/L,即氨水的浓度大于盐酸浓度,反应后氨水过量,溶液呈碱性,则所得溶液的pH>7,
故选B.
点评 本题考查酸碱过量判断,题目难度不大,本题注意溶液H+与OH-离子浓度相等时,氨水过量,侧重于考查学生的分析能力.

练习册系列答案
相关题目
2.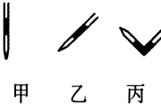 实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度进行实验.请填写下列空白:
实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度进行实验.请填写下列空白:
(1)配制100mL 0.10mol•L-1 NaOH标准溶液.
①主要操作步骤:计算→称量→溶解→(冷却后)转移→洗涤(并将洗涤液移入容量瓶)→定容→摇匀→将配制好的溶液倒入试剂瓶中,贴上标签.
②称量0.4g氢氧化钠固体所需仪器有:托盘天平(带砝码、镊子)、烧杯(或表面皿)、药匙.
(2)取20.00mL待测盐酸放人锥形瓶中,并滴加2〜3滴酚酞作指示剂,用自己配制的NaOH 标准溶液进行滴定.重复上述滴定操作2〜3 次,记录数据如下.
①滴定达到终点的标志是最后加入一滴NaOH溶液,溶液由无色恰好变成浅红色且半分钟内浅红色不褪去.
②根据上述数据,可计算出该盐酸的浓度约为0.11mol/L(保留两位有效数字).
③排除碱式滴定管中气泡的方法应采用如图所示操作中的丙,然后轻轻挤压玻璃球使尖嘴部分充满碱液.
④在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有D.
A.滴定终点读数时俯视
B.酸式滴定管使用前,水洗后未用待测盐酸润洗
C.锥形瓶水洗后未干燥
D.碱式滴定管尖嘴部分有气泡,滴定后消失.
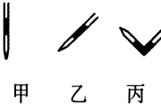 实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度进行实验.请填写下列空白:
实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度进行实验.请填写下列空白:(1)配制100mL 0.10mol•L-1 NaOH标准溶液.
①主要操作步骤:计算→称量→溶解→(冷却后)转移→洗涤(并将洗涤液移入容量瓶)→定容→摇匀→将配制好的溶液倒入试剂瓶中,贴上标签.
②称量0.4g氢氧化钠固体所需仪器有:托盘天平(带砝码、镊子)、烧杯(或表面皿)、药匙.
(2)取20.00mL待测盐酸放人锥形瓶中,并滴加2〜3滴酚酞作指示剂,用自己配制的NaOH 标准溶液进行滴定.重复上述滴定操作2〜3 次,记录数据如下.
实验编号 | NaOH溶液的浓度/(mol•L-1) | 滴定完成时,NaOH溶液滴入的体积/mL | 待测盐酸的体积/mL |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |
②根据上述数据,可计算出该盐酸的浓度约为0.11mol/L(保留两位有效数字).
③排除碱式滴定管中气泡的方法应采用如图所示操作中的丙,然后轻轻挤压玻璃球使尖嘴部分充满碱液.
④在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有D.
A.滴定终点读数时俯视
B.酸式滴定管使用前,水洗后未用待测盐酸润洗
C.锥形瓶水洗后未干燥
D.碱式滴定管尖嘴部分有气泡,滴定后消失.
20.下列说法正确的是( )
| A. | 铁表面镀铜时,铁与电源的正极相连,铜与电源的负极相连 | |
| B. | 向氨水中不断通入CO2,随着CO2的增加,$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$不断增大 | |
| C. | 3C(s)+CaO(s)=CaC2(s)+CO(g)在常温下不能自发进行,说明该反应的△H>0 | |
| D. | 合成氨时,其他条件不变升高温度,反应速率v(H2)和氢气的平衡转化率均增大 |
14.下列有关说法正确的是( )
| A. | 反应CO2(g)+C(s)=2CO(g)在高温下可自发进行,则该反应的△H>0 | |
| B. | 工业上电解饱和食盐水时,以石墨作阴极,铁棒作阳极 | |
| C. | 常温下,0.1mol•L-1 CH3COOH溶液pH=1 | |
| D. | 常温下,在AgCl悬浊液中加入少量NaCl饱和溶液,c(Ag+)减小,Ksp(AgCl) 减小和溶液的pH均增大 |
18.下列“化学与生活”的说法不正确的是( )
| A. | 小苏打可以用于面粉发酵 | B. | SO2可用于漂白纸浆 | ||
| C. | BaCO3在医学上用作钡餐 | D. | 醋可用于除去暖水瓶中的水垢 |
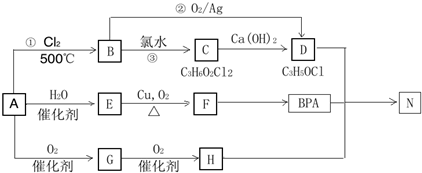

 .
.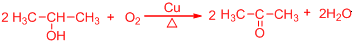 .
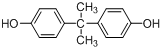
.
 .
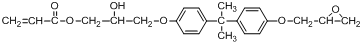
.
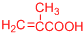 (或
(或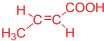 、
、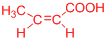 ).
).