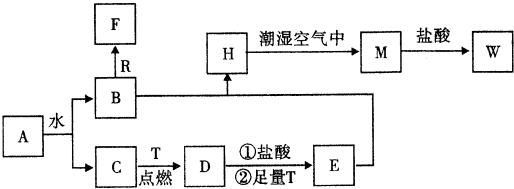
题目内容
14.向含有AgI的饱和溶液中:(1)加入AgCl固体,则c(I-)变小(填“变大”、“变小”或“不变”,下同).
(2)若改加更多的AgI,则c(Ag+)将不变.
(3)若改加AgBr固体,则c(I-)变小,而c(Ag+)变大.
分析 在一定温度下,向AgI的饱和溶液中存在沉淀溶解平衡,平衡状态下存在溶度积常数,依据平衡影响因素分析平衡的变化,
(1)加入AgNO3固体,使c(Ag+)增大,AgI溶解平衡向左移动;
(2)改加更多的AgI固体,仍是该温度下的饱和溶液;
(3)因AgBr的溶解度大于AgI的溶解度,改加AgBr固体时,会使c(Ag+)变大.
解答 解:在一定温度下,向AgI的饱和溶液中存在沉淀溶解平衡,AgI(s)?Ag+(aq)+I-(aq),平衡状态下存在溶度积常数,Ksp=C(Ag+)•C(I-),
(1)若加入AgNO3固体,会增加银离子浓度,沉淀溶解平衡AgI(s)?Ag+(aq)+I-(aq)向左移动,导致c(I-)减小,
故答案为:变小;
(2)若加入更多的AgI固体,沉淀溶解平衡AgI(s)?Ag+(aq)+I-(aq)不移动,则c(Ag+)不变,
故答案为:不变;
(3)若加入固体AgBr,AgBr的溶解性大于AgI,所以平衡状态下AgBr溶液中的银离子浓度大于AgI溶液中的银离子浓度,使c(Ag+)变大,所以碘化银沉淀溶解平衡左移,c(I-)减小,
故答案为:变小;变大.
点评 本题考查了沉淀溶解平衡的分析及其应用,题目难度不大,明确难溶物溶解平衡的影响因素为解答关键,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
5. 有一未知的无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、Na+、Mg2+、Fe3+、Al3+、Cl-、CO32-、SO42-,现取三份100mL溶液进行如下实验:
有一未知的无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、Na+、Mg2+、Fe3+、Al3+、Cl-、CO32-、SO42-,现取三份100mL溶液进行如下实验:
①第一份加足量AgNO3溶液后,有白色沉淀产生.
②第二份加足量BaCl2溶液后,有白色沉淀产生,经洗涤、干燥后,沉淀质量为6.99g.
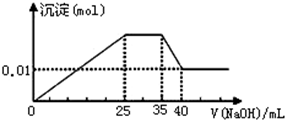
③第三份逐滴滴加NaOH溶液,测得沉淀与NaOH溶液的体积关系如图.
根据上述实验,以下推测不正确的是( )
 有一未知的无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、Na+、Mg2+、Fe3+、Al3+、Cl-、CO32-、SO42-,现取三份100mL溶液进行如下实验:
有一未知的无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、Na+、Mg2+、Fe3+、Al3+、Cl-、CO32-、SO42-,现取三份100mL溶液进行如下实验:①第一份加足量AgNO3溶液后,有白色沉淀产生.
②第二份加足量BaCl2溶液后,有白色沉淀产生,经洗涤、干燥后,沉淀质量为6.99g.
③第三份逐滴滴加NaOH溶液,测得沉淀与NaOH溶液的体积关系如图.
根据上述实验,以下推测不正确的是( )
| A. | 原溶液一定不存在H+、Fe3+、CO32- | |
| B. | 不能确定原溶液是否含有Na+、Cl- | |
| C. | 实验所加的NaOH的浓度为2mol•L-1 | |
| D. | 原溶液确定含Mg2+、Al3+、NH4+,且n(Mg2+):n(Al3+):n( NH4+)=1:1:2 |
19.下列离子方程式与所述事实相符且书写正确的是( )
| A. | 用铁作电极电解饱和氯化钠溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑ | |
| B. | 肥皂水能使酚酞试液变红:C17H35COO-+H2O?C17H35COOH+OH- | |
| C. | FeCl2酸性溶液放在空气中变质:2Fe2++4H++O2═2Fe3++2H2O | |
| D. | 已知苯甲酸的酸性比碳酸强,向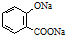 溶液中通入过量CO2: 溶液中通入过量CO2: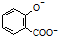 +2CO2+2H2O→ +2CO2+2H2O→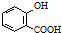 +2HCO3- +2HCO3- |
3.锑(Sb)在自然界一般以硫化物的形式存在,我国锑的蕴藏量占世界第一.从硫化物中提取单质锑一般是先在高温下将硫化物转化为氧化物,再用碳还原:
①2Sb2S3+3O2+6Fe═Sb4O6+6FeS ②Sb4O6+6C═4Sb+6CO
关于反应①、②的说法正确的是( )
①2Sb2S3+3O2+6Fe═Sb4O6+6FeS ②Sb4O6+6C═4Sb+6CO
关于反应①、②的说法正确的是( )
| A. | 反应①②中的氧化剂分别是Sb2S3、Sb4O6 | |
| B. | 反应①中每生成3 mol FeS时,共转移6 mol电子 | |
| C. | 反应②说明高温下Sb的还原性比C强 | |
| D. | 每生成4 mol Sb时,反应①与反应②中还原剂的物质的量之比为4:3 |

 (1)由下列物质冶炼相应金属时采用电解法的是bd.
(1)由下列物质冶炼相应金属时采用电解法的是bd.