题目内容
6.已知A为淡黄色固体,T为生活中使用最广泛常的金属单质,R是地壳中含量最多的金属,D是具有磁性的黑色晶体,C、F是无色无味的气体,H是白色沉淀,W溶液中滴加KSCN溶液出现红色.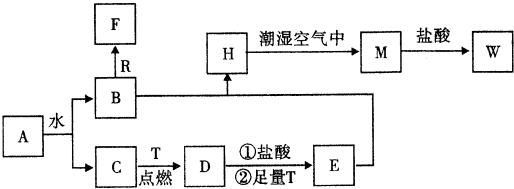
(1)物质A的化学式为Na2O2.
(2)H在潮湿空气中变成M的化学方程式为4Fe(OH)3+O2+2H2O=4Fe(OH)3.
(3)B和R反应生成F的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.
分析 依据转化关系和反应条件,A为淡黄色固体且能与水反应,所以A为Na2O2,T为生活中使用最广泛常的金属单质,则T为Fe,R是地壳中含量最多的金属,则R为Al,D是具有磁性的黑色晶体,则D为Fe3O4,C、F是无色无味的气体,H是白色沉淀,W溶液中滴加KSCN溶液出现红色,则W含有铁离子,过氧化钠与水反应生成B和C,铁与C反应生成Fe3O4,所以C为O2,B为NaOH,D与盐酸反应再与铁反应生成E为FeCl2,B与E反应生成H为Fe(OH)2,H与潮湿的空气反应生成M为Fe(OH)3,M与盐酸反应生成W为FeCl3,C、F是无色无味的气体,氢氧化钠与铝反应生成F为H2,据此答题.
解答 解:依据转化关系和反应条件,A为淡黄色固体且能与水反应,所以A为Na2O2,T为生活中使用最广泛常的金属单质,则T为Fe,R是地壳中含量最多的金属,则R为Al,D是具有磁性的黑色晶体,则D为Fe3O4,C、F是无色无味的气体,H是白色沉淀,W溶液中滴加KSCN溶液出现红色,则W含有铁离子,过氧化钠与水反应生成B和C,铁与C反应生成Fe3O4,所以C为O2,B为NaOH,D与盐酸反应再与铁反应生成E为FeCl2,B与E反应生成H为Fe(OH)2,H与潮湿的空气反应生成M为Fe(OH)3,M与盐酸反应生成W为FeCl3,C、F是无色无味的气体,氢氧化钠与铝反应生成F为H2,
(1)根据上面的分析可知,A为Na2O2,
故答案为:Na2O2;
(2)Fe(OH)2在潮湿空气中变成Fe(OH)3的化学方程式为4Fe(OH)3+O2+2H2O=4Fe(OH)3,
故答案为:4Fe(OH)3+O2+2H2O=4Fe(OH)3;
(3)NaOH和Al反应生成H2的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑.
点评 本题考查了物质转化关系的应用判断,物质性质的应用,主要考查铝及其化合物、铁及其化合物性质的应用,化学方程式、离子方程式书写方法,离子检验方法,物质的特征反应、现象、性质是解题关键.

| A. | HN3水溶液中微粒浓度大小顺序为:c(HN3)>c(N${\;}_{3}^{-}$)>c(H+)>c(OH-) | |
| B. | HN3与NH3作用生成的叠氮酸铵是离子化合物 | |
| C. | NaN3水溶液中离子浓度大小顺序为:c(Na+)>c(N${\;}_{3}^{-}$)>c(OH-)>c(H+) | |
| D. | N${\;}_{3}^{-}$与CO2含相等电子数 |
| A. | 质子数为17、中子数为20的氯原子:${\;}_{17}^{20}$Cl | |
| B. | H2CO3的电离方程式:H2CO3?2H++CO32- | |
| C. | Na2O2的电子式: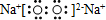 | |
| D. | 乙烯分子的结构简式:CH2CH2. |
| A. | 根据弱酸越稀越电离的规律,0.2mol•L-1 CH3COOH的pH值比0.1mol•L-1 CH3COOH的 pH值大 | |
| B. | 根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是+7 | |
| C. | 根据溶液的pH与溶液酸碱性的关系,推出pH=6.8的溶液一定显酸性 | |
| D. | 根据较强酸可以制取较弱酸的规律,推出CO2通入NaClO溶液中能生成HClO |
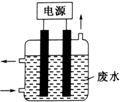 用如图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液PH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是( )
用如图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液PH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是( )| A. | ClO-将CN-氧化过程中,每消耗1molCN-转移10mol电子 | |
| B. | 阳极的电极反应式为:Cl-+2OH--2e-═ClO-+H2O | |
| C. | 阴极的电极反应式为:2H2O+2e-═H2↑+2OH- | |
| D. | 在电解过程中,废水中CN-和Cl-均移向阳极 |
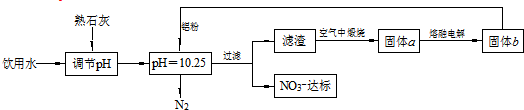
下列说法不正确的是( )
| A. | 该方案在调节pH时,若pH过大或过小都会造成Al的利用率降低 | |
| B. | 为了降低能耗,工业上往往用AlCl3代替固体a来制备固体b | |
| C. | 用熟石灰调节PH主要原因是价格便宜且引入的Ca2+对人体无害 | |
| D. | 在加入铝粉的反应中,氧化产物和还原产物的物质的量之比为10:3 |

 铝和硫的单质及其化合物在工农业生产和生活中有重要的作用.
铝和硫的单质及其化合物在工农业生产和生活中有重要的作用.