题目内容
9.据报道,在全国各地发生了多起因洁污剂混合放出氯气而中毒的事件,各地报刊纷纷转载了不要将不同品牌洁污剂混合使用的警告.请根据你的化学知识试作出推断:当事人使用的液态洁污剂之一必定含氯元素,若可能存在的离子组合是ClO-和Cl-或者ClO3-和Cl-,则当其中一种具有酸性时,二者混合,可能发生反应而产生氯气.
(1)写出ClO3-和Cl-发生反应的离子方程式并表示电子转移方向和数目.

(2)工业氯气泄漏后,可向空气中喷洒氨水,生成大量白烟及空气中含量最多的气体.试写出该过程的化学反应方程式:8NH3+3Cl2=6NH4Cl+N2.
(3)已知:Na2Cr2O7+14HCl(浓)=2CrCl3+2NaCl+3Cl2↑+7H2O,该反应过程中每生成标况下3.36L Cl2,转移的电子数是0.3NA; 被还原掉的物质的物质的量是:0.05mol
(4)若将0.2mol钠、镁、铝分别投入到到100mL 1mol/L的盐酸中,在标准状况下,产生氢气体积比是Na>Mg=Al.
分析 (1)酸溶液中ClO3-和Cl-发生反应生成氯气和水,氯元素化合价+5价变化为0价,-1价变化为0价;
(2)氨气和氯气反应生成氮气和氯化铵;
(3)该反应在Cr元素化合价由+6价变为+3价,部分Cl元素化合价由-1价变为0价,化合价升高的元素为氧化、化合价降低的元素被还原,得电子化合价降低的反应物是氧化剂,氧化剂对应的产物是还原产物关系式计算;
(4)根据反应化学方程式有①2Na+2HCl=2NaCl+H2↑,②Mg+2HCl=MgCl2+H2↑,③2Al+6HCl=2AlCl3+3H2↑,根据三种金属的化合价可得与盐酸反应的关系式分别为:Na~$\frac{1}{2}$H2,Mg~H2,Al~$\frac{3}{2}$H2,根据反应的方程式计算三者的大小.
解答 解:(1)酸溶液中ClO3-和Cl-发生反应生成氯气和水,氯元素化合价+5价变化为0价,-1价变化为0价,反应的离子方程式为:ClO3-+5Cl-+6H+=3Cl2↑+3H2O,表示电子转移方向和数目的离子方程式为: ,
,
故答案为: ;
;
(2)工业氯气泄漏后,可向空气中喷洒氨水,生成大量白烟及空气中含量最多的气体,说明氨气和氯气反应生成氮气和氯化铵,反应的化学方程式为:8NH3+3Cl2=6NH4Cl+N2,
故答案为:8NH3+3Cl2=6NH4Cl+N2;
(3)该反应在Cr元素化合价由+6价变为+3价,部分Cl元素化合价由-1价变为0价,所以Cl元素被氧化、Cr元素被还原,K2Cr2O7作氧化剂、CrCl3为还原产物,标况下3.36L 氯气的物质的量是0.15mol,其转移电子数=0.15mol×2×NA/mol=0.3NA,被还原掉的物质的物质的量是$\frac{1}{20}$=0.05mol,故答案为:0.3NA;0.05mol;
(4)由于Na与水反应生成氢气,故无论HCl是否足量,Na都完全反应生成氢气,根据2Na~H2↑可知,Na生成氢气气体物质的量为$\frac{0.2mol}{2}$=0.1mol;
HCl的物质的量为0.1L×1mol/L=0.1mol,由Mg+2HCl=MgCl2+H2↑,Al+6HCl=2AlCl3+3H2↑,可知HCl不足量,根据HCl可知二者生成氢气体积相等,根据H原子守恒,而生成氢气物质的量为$\frac{0.1}{2}$=0.05mol,
故标准状况下产生氢气的体积大小顺序是:Na>Mg=Al,
故答案为:Na>Mg=Al.
点评 本题主要考查化学方程式计算,涉及过量计算,难度不大,注意Na能与水反应生成氢气.

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案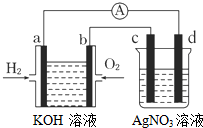 氢氧燃料电池能量转化率高,具有广阔的发展前景.现用氢氧燃料电池进行如图所示的实验(图中所用电极均为惰性电极),下列叙述正确的是( )
氢氧燃料电池能量转化率高,具有广阔的发展前景.现用氢氧燃料电池进行如图所示的实验(图中所用电极均为惰性电极),下列叙述正确的是( )| A. | a电极是负极,OH-移向正极 | |
| B. | b电极的电极反应为:O2+2H2O+4e-═4OH- | |
| C. | 燃料电池中电解质溶液的pH保持不变 | |
| D. | d电极有气体放出 |
①形成化学键的过程一定是化学变化
②铁分别与氯气和稀盐酸反应所得的氯化物相同
③为测定熔融氢氧化钠的导电性,可将氢氧化钠固体放在石英坩埚中加热熔化
④常温下,pH=12的溶液一定能大量存在:K+、Cl-、SO32-、S2-
⑤在“石蜡→液体石蜡→石蜡蒸气→裂化气”的变化过程中,被破坏的作用力依次是:范德华力、共价键、共价键.
| A. | ①②③⑤ | B. | ②③④ | C. | ①③④ | D. | ①②④⑤ |
| A. | HN3水溶液中微粒浓度大小顺序为:c(HN3)>c(N${\;}_{3}^{-}$)>c(H+)>c(OH-) | |
| B. | HN3与NH3作用生成的叠氮酸铵是离子化合物 | |
| C. | NaN3水溶液中离子浓度大小顺序为:c(Na+)>c(N${\;}_{3}^{-}$)>c(OH-)>c(H+) | |
| D. | N${\;}_{3}^{-}$与CO2含相等电子数 |
| A. | 根据弱酸越稀越电离的规律,0.2mol•L-1 CH3COOH的pH值比0.1mol•L-1 CH3COOH的 pH值大 | |
| B. | 根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是+7 | |
| C. | 根据溶液的pH与溶液酸碱性的关系,推出pH=6.8的溶液一定显酸性 | |
| D. | 根据较强酸可以制取较弱酸的规律,推出CO2通入NaClO溶液中能生成HClO |
| A. | 室温下测定等浓度氨水和NaOH溶液的pH,比较氨水和NaOH碱性强弱 | |
| B. | 将氨水缓慢滴入AlCl3溶液中,研究Al(OH)3的两性 | |
| C. | 将蘸有浓氨水和浓硫酸的玻璃棒靠近,观察到白烟 | |
| D. | 加热除去NH4Cl中的少量NaHC03 |
 铝和硫的单质及其化合物在工农业生产和生活中有重要的作用.
铝和硫的单质及其化合物在工农业生产和生活中有重要的作用. Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.
Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.