题目内容
甲醇可作为燃料电池的原料.通过下列反应可以制备甲醇:
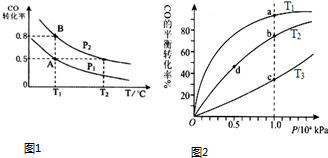
CO(g)+2H2(g)?CH3OH(g)△H=-90.8kJ?mol-1在一容积可变的密闭容器中充入10mol CO和20mol H2,CO 的平衡转化率随温度(T)、压强(P)的变化如图1所示,当达到平衡状态A时,容器的体积为20L.
(1)该反应的化学平衡常数表达式为 .
(2)如反应开始时仍充入10mol CO 和20mol H2,则在平衡状态B时容器的体积V(B)= L.
(3)关于反应CO(g)+2H2(g)?CH3OH(g)在化学平衡状态时的描述正确的是 (填
字母).
A.CO的含量保持不变
B.容器中CH3OH浓度与CO浓度相等
C.2V正(CH3OH)=V正(H2)
D.容器中混合气体的平均相对分子质量保持不变
(4)CO(g)+2H2(g)?CH3OH(g),按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图2所示.下列说法正确的是 .
A.温度:T1<T2<T3
B.正反应速率:ν(a)>ν(c);ν(b)>ν(d)
C.平衡常数:K(a)=K(c);K(b)>K(d)
D.平均摩尔质量:M(a)<M(c);M(b)>M(d)
(5)已知CO2(g)+H2(g)?CO(g)+H2O(g)△H=+41.3kJ?mol-1,试写出由CO2和H2制取甲醇的热化学方程式 .
CO(g)+2H2(g)?CH3OH(g)△H=-90.8kJ?mol-1在一容积可变的密闭容器中充入10mol CO和20mol H2,CO 的平衡转化率随温度(T)、压强(P)的变化如图1所示,当达到平衡状态A时,容器的体积为20L.

(1)该反应的化学平衡常数表达式为
(2)如反应开始时仍充入10mol CO 和20mol H2,则在平衡状态B时容器的体积V(B)=
(3)关于反应CO(g)+2H2(g)?CH3OH(g)在化学平衡状态时的描述正确的是
字母).
A.CO的含量保持不变
B.容器中CH3OH浓度与CO浓度相等
C.2V正(CH3OH)=V正(H2)
D.容器中混合气体的平均相对分子质量保持不变
(4)CO(g)+2H2(g)?CH3OH(g),按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图2所示.下列说法正确的是
A.温度:T1<T2<T3
B.正反应速率:ν(a)>ν(c);ν(b)>ν(d)
C.平衡常数:K(a)=K(c);K(b)>K(d)
D.平均摩尔质量:M(a)<M(c);M(b)>M(d)
(5)已知CO2(g)+H2(g)?CO(g)+H2O(g)△H=+41.3kJ?mol-1,试写出由CO2和H2制取甲醇的热化学方程式
考点:化学平衡常数的含义,热化学方程式,化学平衡的影响因素,化学平衡状态的判断
专题:化学反应中的能量变化,化学平衡专题
分析:(1)平衡常数为产物浓度系数次幂的乘积与反应物浓度系数次幂的乘积的比值;
(2)A、B温度相同,则化学平衡常数也相同,可利用A点时计算出化学平衡常数,计算得出B的体积;
(3)根据化学平衡状态的判断依据进行判断;
(4)观察图象根据图象中曲线走势判断各选项;
(5)利用盖斯定律计算得出热化学方程式.
(2)A、B温度相同,则化学平衡常数也相同,可利用A点时计算出化学平衡常数,计算得出B的体积;
(3)根据化学平衡状态的判断依据进行判断;
(4)观察图象根据图象中曲线走势判断各选项;
(5)利用盖斯定律计算得出热化学方程式.
解答:
解:(1)平衡常数为产物浓度系数次幂的乘积与反应物浓度系数次幂的乘积的比值,K=
,故答案为:K=
;
(2)密闭容器中充入10mol CO和20mol H2,达到平衡状态A时,CO转化率为0.5,此时各物质的物质的量为CO为5mol,H2为10mol,CH3OH为5mol,气体的物质的量为20mol,容器体积为20L;若反应开始时仍充入10mol CO 和20mol H2,达到平衡状态B时,CO转化率为0.8,此时各物质的物质的量为CO为2mol,H2为4mol,CH3OH为8mol,气体的物质的量为14mol;由于A、B温度相同,化学平衡常数相同,设B点气体体积为V,则有
=
,V=4L,故答案为4;
(3)A、CO的含量保持不变,各组分的物质的量,总物质的量不变,达到化学平衡状态,故A正确;
B、容器中CH3OH浓度与CO浓度相等,是一个比较特殊的情况,此时可能达到平衡状态,也可能未达到平衡状态,故B错误;
C、2V正(CH3OH)=V正(H2),若2V正(CH3OH)=V逆(H2),则V正(H2)=V逆(H2),达到化学平衡状态,故C正确;
D、M平均=
,气体总质量不变,反应前后计量数不同,即反应前后气体n总不同,所以当M平均不变时,达到了化学平衡状态,故D正确;
故选ACD;
(4)A、由于该反应的正反应为放热反应,在其他条件不变的情况下,升高温度,平衡向吸热的方向移动,即向逆反应方向移动,反应物转化率降低,由于a>b>c,所以:温度:T1<T2<T3,故A正确;
B、在其他条件不变的情况下,升高温度,化学反应速率加快,由于温度T1<T2<T3,速率ν(c)>ν(a);在其他条件相同时,增大压强,化学反应速率加快,由于压强b>d,速率ν(b)>ν(d),故B错误;
C、化学平衡常数只与温度有关,由于T1<T2<T3,升高温度,平衡向逆反应方向移动,K减小,
K(a)>K(c),K(b)=K(d),故C错误;
D、升高温度,平衡向逆反应方向移动,平衡时气体的物质的量增大,气体的平均摩尔质量减小,由于温度T1<T2<T3,所以平衡时n(c)>n(a),M(a)>M(c);
在相同温度下,增大压强,平衡正向移动,平衡时气体的物质的量减小,所以平衡时n(d)>n(b),M(b)>M(d),故D错误;
故选A;
(5)将CO(g)+2H2(g)?CH3OH(g)△H=-90.8kJ?mol-1与CO2(g)+H2(g)?CO(g)+H2O(g)△H=+41.3kJ?mol-1,相加可得到CO2和H2制取甲醇的热化学方程式CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.5 kJ?mol-1,故答案为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.5 kJ?mol-1.
| c(CH3OH) |
| c2(H2O)?c(CO) |
| c(CH3OH) |
| c2(H2O)?c(CO) |
(2)密闭容器中充入10mol CO和20mol H2,达到平衡状态A时,CO转化率为0.5,此时各物质的物质的量为CO为5mol,H2为10mol,CH3OH为5mol,气体的物质的量为20mol,容器体积为20L;若反应开始时仍充入10mol CO 和20mol H2,达到平衡状态B时,CO转化率为0.8,此时各物质的物质的量为CO为2mol,H2为4mol,CH3OH为8mol,气体的物质的量为14mol;由于A、B温度相同,化学平衡常数相同,设B点气体体积为V,则有
| ||||
|
| ||||
|
(3)A、CO的含量保持不变,各组分的物质的量,总物质的量不变,达到化学平衡状态,故A正确;
B、容器中CH3OH浓度与CO浓度相等,是一个比较特殊的情况,此时可能达到平衡状态,也可能未达到平衡状态,故B错误;
C、2V正(CH3OH)=V正(H2),若2V正(CH3OH)=V逆(H2),则V正(H2)=V逆(H2),达到化学平衡状态,故C正确;
D、M平均=
| m总 |
| n总 |
故选ACD;
(4)A、由于该反应的正反应为放热反应,在其他条件不变的情况下,升高温度,平衡向吸热的方向移动,即向逆反应方向移动,反应物转化率降低,由于a>b>c,所以:温度:T1<T2<T3,故A正确;
B、在其他条件不变的情况下,升高温度,化学反应速率加快,由于温度T1<T2<T3,速率ν(c)>ν(a);在其他条件相同时,增大压强,化学反应速率加快,由于压强b>d,速率ν(b)>ν(d),故B错误;
C、化学平衡常数只与温度有关,由于T1<T2<T3,升高温度,平衡向逆反应方向移动,K减小,
K(a)>K(c),K(b)=K(d),故C错误;
D、升高温度,平衡向逆反应方向移动,平衡时气体的物质的量增大,气体的平均摩尔质量减小,由于温度T1<T2<T3,所以平衡时n(c)>n(a),M(a)>M(c);
在相同温度下,增大压强,平衡正向移动,平衡时气体的物质的量减小,所以平衡时n(d)>n(b),M(b)>M(d),故D错误;
故选A;
(5)将CO(g)+2H2(g)?CH3OH(g)△H=-90.8kJ?mol-1与CO2(g)+H2(g)?CO(g)+H2O(g)△H=+41.3kJ?mol-1,相加可得到CO2和H2制取甲醇的热化学方程式CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.5 kJ?mol-1,故答案为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.5 kJ?mol-1.
点评:本题考查了热化学方程式和盖斯定律计算应用、化学平衡状态的特征及判断、化学平衡图象等知识,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列变化过程中未必吸热的是( )
| A、电解质在熔融状态下电离 |
| B、共价键断裂 |
| C、原子失电子 |
| D、溶解 |
右表为元素周期表前四周期的一部分,且X、Y、Z、R和W为主族元素.下列说法正确的是( )
| X | |||
| Y | Z | R | |
| W |
| A、五种元素可能都是金属元素 |
| B、X的氢化物的沸点一定比Z的氢化物的沸点高 |
| C、R的最高价氧化物对应的水化物一定是强酸 |
| D、五种元素的原子最外层电子数一定都大于2 |