题目内容
17.46g NO2和N2O4的混合气体其分子数最多接近6.02×1023,氧原子数目为1.204×1024.分析 存在平衡2NO2?N2O4,只有NO2时含有分子数目最多,只有N2O4时含有分子数目最少,NO2和N2O4混合气体中O元素质量分数为$\frac{32}{46}$,据此计算氧原子质量,再根据n=$\frac{m}{M}$计算O原子物质的量,再根据N=nNA计算O原子数目.
解答 解:存在平衡2NO2?N2O4,只有NO2时含有分子数目最多,分子数最多接近为$\frac{46g}{46g/mol}$×6.02×1023mol-1=6.02×1023,只有N2O4时含有分子数目最少,分子数最少接近为$\frac{46g}{92g/mol}$×6.02×1023mol-1=3.01×1023,
NO2和N2O4混合气体中O元素质量分数为$\frac{32}{46}$,氧原子质量=46g×$\frac{32}{46}$=32g,O原子物质的量=$\frac{32g}{16g/mol}$=2mol,故含有O原子数目=2mol×6.02×1023mol-1=1.204×1024,
故答案为:6.02×1023;1.204×1024.
点评 本题考查物质的量有关计算,比较基础,题目中注意分析化学式确定氧元素质量分数,注意对基础知识的理解掌握.

练习册系列答案
相关题目
7.常温下KSp(AgCl)=1.8×10-10,KSp(AgI)=1.0×10-16,将等体积的AgCl和AgI的饱和溶液的清液混合,再向其中加入一定量的AgNO3固体,下列说法正确的是( )
| A. | 两清液混合,AgCl和AgI都沉淀 | |
| B. | 向AgI清液加入AgNO3,c(Ag+)增大,KSp(AgI)也增大 | |
| C. | 若取0.1435克AgCl固体放入100mL水(忽略体积变化),c(Cl-)为0.01mol/L | |
| D. | 若AgNO3足量,AgCl和AgI都可沉淀,但以AgCl为主 |
8.下列说法正确的是( )
| A. | 油脂有油和脂肪之分,在分类上都属于酯类 | |
| B. | 油脂、蛋白质都是由C、H、O三种元素组成 | |
| C. | 糖类、油脂、蛋白质都是高分子化合物 | |
| D. | 糖类、油脂、蛋白质都能发生水解反应 |
5.下列反应氯元素只被氧化的是( )
| A. | 5Cl2+I2+6H2O=10HCl+2HIO3 | B. | MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+H2O | ||
| C. | 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O | D. | 2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑ |
12.在某无色酸性溶液中能大量共存的一组离子是( )
| A. | Na+、K+、CO32-、NO3- | B. | K+、MnO4-、NH4+、NO3- | ||
| C. | NH4+、SO42-、Al3+、NO3- | D. | Na+、Ca2+、NO3-、CO32- |
2.既能通过金属单质与足量Cl2反应得到,也能通过金属单质与酸反应得到的是( )
| A. | FeCl2 | B. | NaCl | C. | FeCl3 | D. | CuCl2 |
9.NaCl是一种化工原料,可以制备一系列物质(如图所示).下列说法正确的是( )
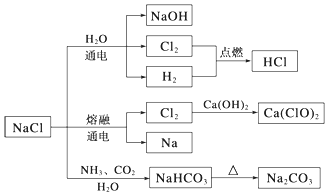

| A. | 由氯化钠制备纯碱的过程中,利用了物质溶解度的差异 | |
| B. | 用Cl2制备漂白粉时,是将Cl2通入澄清石灰水中 | |
| C. | 常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应 | |
| D. | 图示转化反应都是氧化还原反应 |