题目内容
5.下列反应氯元素只被氧化的是( )| A. | 5Cl2+I2+6H2O=10HCl+2HIO3 | B. | MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+H2O | ||
| C. | 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O | D. | 2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑ |
分析 氯元素只被氧化,可知反应中Cl元素的化合价只升高,失去电子被氧化,以此来解答.
解答 解:A.Cl元素的化合价降低,被还原,故A不选;
B.Cl元素的化合价升高,Mn元素的化合价降低,则氯元素只被氧化,故B选;
C.Cl元素的化合价既升高又降低,故C不选;
D.Cl元素的化合价降低,被还原,故D不选;
故选B.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意基本概念的应用,题目难度不大.

练习册系列答案
相关题目
16.下列热化学方程式书写正确的是(△H的绝对值均正确)( )
| A. | C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-110.5KJ•mol-1(燃烧热) | |
| B. | C2H5OH+3O2═2CO2+3H2O△H=-1368.8KJ•mol-1(反应热) | |
| C. | 2NaOH(aq)+H2SO4(aq)═Na2SO4(aq)+2H2O (l)△H=-114.6KJ•mol-1(中和热) | |
| D. | 2H2O(g)═2H2(g)+O2(g)△H=+483.6KJ•mol-1(反应热) |
13.下列叙述正确的是( )
| A. | 碱金属元素单质的熔点随核电荷数增大而升高 | |
| B. | 同一周期元素的原子,半径越小越容易失去电子 | |
| C. | 第ⅥA族元素的氢化物相对分子质量越大,沸点越高 | |
| D. | 卤族元素的原子序数越大,其单质的沸点一定越高 |
20.在2A+B?3C+5D反应中,表示该反应速率最快的是( )
| A. | υ(A)=0.6 mol/(L•s) | B. | υ(B)=0.2 mol/(L•s) | C. | υ(C)=0.8 mol/(L•s) | D. | υ(D)=1mol/(L•s) |
10.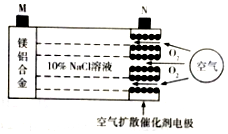 中科院宁波材料所研发金属空气电池获得重大突破.该电池的工作原理如图所示:下列有关说法正确的是( )
中科院宁波材料所研发金属空气电池获得重大突破.该电池的工作原理如图所示:下列有关说法正确的是( )
 中科院宁波材料所研发金属空气电池获得重大突破.该电池的工作原理如图所示:下列有关说法正确的是( )
中科院宁波材料所研发金属空气电池获得重大突破.该电池的工作原理如图所示:下列有关说法正确的是( )| A. | 电池工作时,负极附近溶液的pH升高 | |
| B. | 电池工作时,电流由M极经外电路流向N极 | |
| C. | 电路中转移2mol电子,理论上约消耗标准状况下空气56L | |
| D. | 电池总反应为4Al+3O2=2Al2O3、2Mg+O2=2MgO |
14.一定条件下,X(g)+3Y(g)?2Z(g)达到化学平衡的标志是( )
| A. | Z的分解速率和Y的生成速率相等 | |
| B. | 单位时间内生成nmolZ,同时生成nmolX | |
| C. | 反应体系的总质量保持不变 | |
| D. | X、Y、Z的浓度不再变化 |
4.下列说法正确的是( )
| A. | 难溶电解质的溶度积越小,溶解度越大 | |
| B. | 可以通过沉淀反应使杂质离子完全沉淀 | |
| C. | 难溶电解质的溶解平衡是一种动态平衡 | |
| D. | AgCl固体在等浓度的NaCl、CaCl2溶液中的溶解度相同 |
