��Ŀ����
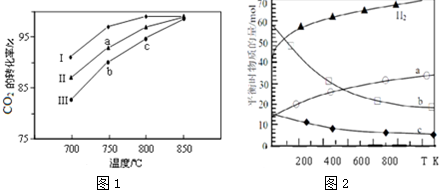
16����֪��ӦA��g��+B��g��?C��g��+D��g����830�������£��ﵽƽ��ʱ������ͷ�Ӧ��Ĺ�ϵʽ$\frac{c��C��•c��D��}{c��A��•c��B��}$Ϊһ����������ֵΪ1����1��830��ʱ����һ��1L�ܱ������г���0.04mol��A��0.16mol��B��
���練Ӧ��ʼ6s��A��ƽ����Ӧ����v��A��=0.003mol•L-1•s-1����6sʱc��A��=0.022 mol•L-1��C�����ʵ���Ϊ0.018mol��
������Ӧ����һ��ʱ��ﵽƽ��ʱA��ת����Ϊ80%��
��2���жϸ÷�Ӧ�Ƿ�ﵽƽ�������Ϊc������ȷѡ��ǰ����ĸ����
a��ѹǿ����ʱ��ı�
b��������ܶȲ���ʱ��ı�
c��c��A������ʱ��ı�
d����λʱ��������C��D�����ʵ�����ȣ�
���� ��1���ٸ��ݡ�c=v•t���㷴Ӧ6s��A���뷴Ӧ�������ټ���6sĩA��Ũ�ȣ����ݻ�ѧ����������C�����ʵ�����
������뷴Ӧ��AΪx��������ʽ����ƽ��ʱ�����ʵ�Ũ�ȣ�����ƽ�ⳣ��Ϊ1������x��ֵ���ټ���ת���ʣ�
��2������ƽ��״̬�������������ʵĺ������ٸı������
��� �⣺��1�����練Ӧ��ʼ6 s��A��ƽ����Ӧ����v��A��=0.003 mol•L-1•s-1����6 s�ڡ�c��A��=v��A����t=0.003 mol•L-1•s-1��6s=0.018 mol•L-1����ʱc��A��=0.04mol•L-1-0.018mol•L-1=0.022mol•L-1�����뷴Ӧ��AΪ0.018mol����C�����ʵ���Ϊ0.018mol��
�ʴ�Ϊ��0.022��0.018��
����ﵽƽ��ʱA��Ӧ��x��������ʽ��
A��g��+B��g��?C��g��+D��g��
��ʼ����0.04 0.16 0 0
ת������x x x x
ƽ������0.04-x 0.16-x x x
����830�������£�ƽ�ⳣ��Ϊ1��$\frac{{x}^{2}}{��0.04-x����0.16-x��}$=1����ã�x=0.032����A��ת����Ϊ$\frac{0.032}{0.04}��100%$=80%��
�ʴ�Ϊ��80%��
��2��a���÷�Ӧ�Ǹ������������ķ�Ӧ��ѹǿʼ�ղ��䣬�ʲ�����Ϊƽ��״̬�ı�־��a����
b����������������䣬����������䣬���ݦ�=$\frac{m}{V}$��֪�ܶ�ʼ�ղ��䣬b����
c��ƽ��ʱ�����ʵ�Ũ�Ȳ��ٱ仯��c��ȷ��
d�����ݷ�Ӧ���κ�ʱ������C��D�����ʵ�����ȣ�d����
�ʴ�Ϊ��c��
���� ���⿼���˻�ѧƽ����йؼ��㣬��ѧƽ�ⳣ����Ӧ�ã�ƽ��״̬���жϣ�ѧ��Ӧע�����֪ʶ�����գ���Ŀ�Ѷ��еȣ�

 ���б�ˢ��ϵ�д�
���б�ˢ��ϵ�д�| A�� | ���� | B�� | ���� | C�� | �ᾧ | D�� | ��ȡ |
| A�� | ���ܵ���ʵ��ܶȻ�ԽС���ܽ��Խ�� | |
| B�� | ����ͨ��������Ӧʹ����������ȫ���� | |
| C�� | ���ܵ���ʵ��ܽ�ƽ����һ�ֶ�̬ƽ�� | |
| D�� | AgCl�����ڵ�Ũ�ȵ�NaCl��CaCl2��Һ�е��ܽ����ͬ |
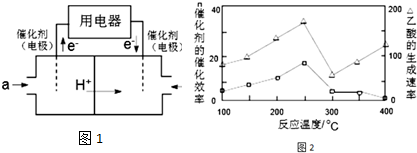
 �����£���һ��4L���ܱ������г���5.2molH2��2molN2����Ӧ�����ж�NH3��Ũ�Ƚ��м�⣬�õ������������ʾ��
�����£���һ��4L���ܱ������г���5.2molH2��2molN2����Ӧ�����ж�NH3��Ũ�Ƚ��м�⣬�õ������������ʾ��| ʱ��/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c��NH3��/mol•L-1 | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
A��N2��H2��NH3��Ũ�Ȳ��ٱ仯
B����λʱ��������n mol N2ͬʱ����3nmol H2
C.1mol������������ͬʱ6molN-H������
D����������ѹǿ����ʱ����仯
E�����������ܶȱ��ֲ���
F����������ƽ����Է����������ٸı�
�ڴ������¸÷�Ӧ�Ļ�ѧƽ�ⳣ��K=0.1�����¶Ȳ��䣬ֻ�����������4L��Ϊ2L���ﵽ��ƽ��ʱN2��ƽ��Ũ�ȣ�0.4mol•L-1�����������=����������
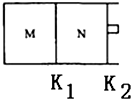
����ͼ��ʾ������K1�̶�����������K2�������ƶ���T��ʱ��M��N���������о�������ӦN2��g��+3H2��g��?2NH3��g����������M��N�и�����l mol N2��3mol H2����ʼM��N���ݻ����¶���ͬ���������¶Ȳ��䣮�����й�˵���в���ȷ����A��
A����Ӧ�ﵽƽ��ʱN2��ת���ʣ�M��N
B��H2�����������M��N
C������N�дﵽƽ�⣬��������к���1.2mol NH3����ʱN���ݻ�ΪVL����÷�Ӧ�ڴ������µ�ƽ�ⳣ��K=
$\frac{24{V}^{2}}{12}$
D���÷�Ӧ��T��ʱ��ƽ�ⳣ��K��M=N��
| A�� | ��пת����ͭ�������ӷ���ʽΪZnS��s��+Cu2+��aq��=Zn2+��aq��+CuS��s�� | |
| B�� | �ڰ�ɫ��п��Һ�еμ�����Ǧ��Һ���������ɺ�ɫ������PbS�� | |
| C�� | ��ˮ�е��ܽ�ȣ�S��ZnS����S��PbS����S��CuS�� | |
| D�� | ����Һ��c��Cu2+��=1��10-10mol•L-1����S2-����ȫת����CuS |