题目内容
20.元素①~⑧在元素周期表中的位置如下,回答有关问题: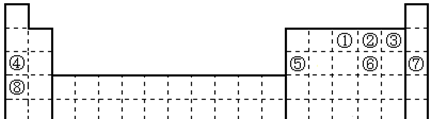
(1)写出⑦元素名称氩,画出⑥的离子结构示意图
 ;写出②含有10个中子的核素的化学符号${\;}_{8}^{18}$O.
;写出②含有10个中子的核素的化学符号${\;}_{8}^{18}$O.(2)在②、③、④、⑤四种元素中,其离子半径按由大到小的排列顺序为r(O2-)>r(F-)>r(Na+)>r(Al3+),.(用化学式表示,下同)
(3)②③⑥元素氢化物的稳定性由强到弱的顺序为HF>H2O>H2S(填化学式).
(4)请写出①的氢化物发生催化氧化的化学方程式4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
(5)表中能形成两性氢氧化物的元素是Al(填元素符号),写出该元素的氧化物与⑧的最高价氧化物的水化物反应的离子方程式Al2O3+2OH-=H2O+2AlO2-
(6)由②④⑥三种元素组成的一种盐在空气中放置会变质,请用化学方程式表示变质的反应2Na2SO3+O2=2Na2SO4.
分析 由元素在周期表的位置,①~⑧分别为N、O、F、Na、Al、S、Ar、K,
(1)⑦为Ar,⑥的质子数为16、离子的核外电子数为18,②含有10个中子的核素,其质量数为18;
(2)具有相同电子排布的离子中原子序数大的离子半径小;
(3)非金属性越强,对应氢化物越稳定;
(4)氨气催化氧化生成NO和水;
(5)氢氧化铝为两性氢氧化物,氧化铝与KOH反应生成偏铝酸钾和水;
(6)②④⑥三种元素组成的一种盐在空气中放置会变质,为亚硫酸钠被氧化生成硫酸.
解答 解:由元素在周期表的位置,①~⑧分别为N、O、F、Na、Al、S、Ar、K,
(1)⑦为Ar,名称为氩;⑥的质子数为16、离子的核外电子数为18,⑥的离子结构示意图为
故答案为:氩;
(2)具有相同电子排布的离子中原子序数大的离子半径小,则②、③、④、⑤四种元素中,其离子半径由大到小的排列顺序为r(O2-)>r(F-)>r(Na+)>r(Al3+),故答案为:r(O2-)>r(F-)>r(Na+)>r(Al3+);
(3)非金属性越强,对应氢化物越稳定,则②③⑥元素氢化物的稳定性由强到弱的顺序为HF>H2O>H2S,
故答案为:HF>H2O>H2S;
(4)氨气催化氧化生成NO和水,反应为4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,
故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
(5)氢氧化铝为两性氢氧化物,则表中能形成两性氢氧化物的元素是Al,氧化铝与KOH反应生成偏铝酸钾和水,离子反应为Al2O3+2OH-=H2O+2AlO2-,
故答案为:Al;Al2O3+2OH-=H2O+2AlO2-;
(6)②④⑥三种元素组成的一种盐在空气中放置会变质,为亚硫酸钠被氧化生成硫酸,该反应为2Na2SO3+O2=2Na2SO4,
故答案为:2Na2SO3+O2=2Na2SO4.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、性质、元素化合物知识为解答的关键,侧重分析与应用能力的考查,注意化学用语的使用,题目难度不大.

| A. |  | B. |  | ||
| C. |  | D. |  |
| A. | 用灼烧的方法可以区分蚕丝和人造纤维 | |
| B. | 食用油反复加热会产生稠环芳香烃等有害物质 | |
| C. | 加热能杀死流感病毒是因为蛋白质受热变性 | |
| D. | 用聚氯乙烯代替聚乙烯作食品包装袋,有利于节约成本 |
 如图所示,将两烧杯中电极用导线相连,四个电极分别为Mg、Al、Pt、C.当闭合开关S后,以下表述正确的是( )
如图所示,将两烧杯中电极用导线相连,四个电极分别为Mg、Al、Pt、C.当闭合开关S后,以下表述正确的是( )| A. | 电流表指针不发生偏转 | |
| B. | Al、Pt两极有H2产生 | |
| C. | 甲池pH增大,乙池pH减小 | |
| D. | Mg、C两极生成的气体在一定条件下可以恰好完全反应 |
| A. | 气态氢化物的稳定性:D>C | B. | 四种元素一定属于短周期元素 | ||
| C. | 单质的还原性:B>A | D. | 原子序数:b>a>c>d |
| A. | 颜色变浅 | B. | 逐渐变红色 | C. | 没有改变 | D. | 变棕黄色 |
| A. | NH2- | B. | Cl | C. | NH3 | D. | Na+ |
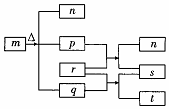 短周期元素W、X、Y、Z的原子序数依次增加.m、p、r是由这些元素组成的二元化合物,常温常压下,p为无色无味气体,q为液态,r为淡黄色固体,s是气体单质.上述物质的转化关系如图所示.下列说法错误的是( )
短周期元素W、X、Y、Z的原子序数依次增加.m、p、r是由这些元素组成的二元化合物,常温常压下,p为无色无味气体,q为液态,r为淡黄色固体,s是气体单质.上述物质的转化关系如图所示.下列说法错误的是( )| A. | 原子半径:Z>Y>X | B. | 最简单气态氢化物的稳定性:Y>X | ||
| C. | m、n、r都含有离子键和共价键 | D. | m、n、t都能破坏水的电离平衡 |
 HSO3-+OH-水解平衡事实的是
HSO3-+OH-水解平衡事实的是