题目内容
15.现有MgCl2和Al2(SO4)3混合溶液,向其中不断加入Na2O2,得到沉淀的量与加入Na2O2的物质的量如图所示,原溶液中Cl-与SO42-的物质的量之比为( )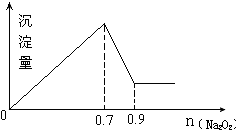
| A. | 1:3 | B. | 2:3 | C. | 6:1 | D. | 3:1 |
分析 由图可知加入0.7olNaOH,沉淀达最大量,沉淀为氢氧化镁、氢氧化铝,根据氢氧根守恒可知2n[Mg(OH)2]+3n[Al(OH)3]=n(OH-)=0.7mol,加入0.9molNaOH时,沉淀由最大值减小为最小值,故0.2molNaOH溶解氢氧化铝沉淀,根据反应Al(OH)3+NaOH=NaAlO2+2H2O可知,n[Al(OH)3]=0.2mol,计算出n[Mg(OH)2],根据化学式MgCl2可知溶液中n(Cl-)=2n[Mg(OH)2],根据化学式Al2(SO4)3可知溶液中n(SO42-)=$\frac{3}{2}$n[Al(OH)3],据此计算判断.
解答 解:由图可知加入0.7olNaOH,沉淀达最大量,沉淀为氢氧化镁、氢氧化铝,根据氢氧根守恒可知2n[Mg(OH)2]+3n[Al(OH)3]=n(OH-)=0.7mol,加入0.9molNaOH时,沉淀由最大值减小为最小值,故0.2molNaOH溶解氢氧化铝沉淀,根据反应Al(OH)3+NaOH=NaAlO2+2H2O可知,n[Al(OH)3]=0.2mol,计算出n[Mg(OH)2],根据化学式MgCl2可知溶液中n(Cl-)=2n[Mg(OH)2]=0.1mol,根据化学式Al2(SO4)3可知溶液中n(SO42-)=$\frac{3}{2}$n[Al(OH)3]=$\frac{3}{2}$×0.1mol=0.15mol,所以原溶液中Cl-与SO42-的物质的量之比为0.1mol:0.15mol=2:3.
故选:B.
点评 本考查离子反应计算、化学反应图象计算等,难度中等,清楚图象中各阶段发生的反应是解题的关键.

练习册系列答案
相关题目
5.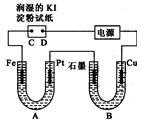 电解装置如图所示.图中B装置盛1000mL 3mol•L-1Na2SO4溶液,A装置中盛1000mL 3mol•L-1AgNO3溶液.通电一段时间后,润湿的淀粉KI试纸的C端变蓝色.室温下,若从电解开始到时间为t时,A、B装置中共收集到16.8mL(标准状况)气体.若电解过程中无其他副反应发生,且溶液体积变化忽略不计,下列判断正确的是( )
电解装置如图所示.图中B装置盛1000mL 3mol•L-1Na2SO4溶液,A装置中盛1000mL 3mol•L-1AgNO3溶液.通电一段时间后,润湿的淀粉KI试纸的C端变蓝色.室温下,若从电解开始到时间为t时,A、B装置中共收集到16.8mL(标准状况)气体.若电解过程中无其他副反应发生,且溶液体积变化忽略不计,下列判断正确的是( )
 电解装置如图所示.图中B装置盛1000mL 3mol•L-1Na2SO4溶液,A装置中盛1000mL 3mol•L-1AgNO3溶液.通电一段时间后,润湿的淀粉KI试纸的C端变蓝色.室温下,若从电解开始到时间为t时,A、B装置中共收集到16.8mL(标准状况)气体.若电解过程中无其他副反应发生,且溶液体积变化忽略不计,下列判断正确的是( )
电解装置如图所示.图中B装置盛1000mL 3mol•L-1Na2SO4溶液,A装置中盛1000mL 3mol•L-1AgNO3溶液.通电一段时间后,润湿的淀粉KI试纸的C端变蓝色.室温下,若从电解开始到时间为t时,A、B装置中共收集到16.8mL(标准状况)气体.若电解过程中无其他副反应发生,且溶液体积变化忽略不计,下列判断正确的是( )| A. | 电子流动的方向:Fe→Pt→石墨→Cu | |
| B. | B中石墨上可能有红色物质析出 | |
| C. | 若把Fe电极改成Ag电极,可向Pt上镀银 | |
| D. | t时A溶液的pH为3 |
10.油脂既是重要食物,又是重要的化工原料.油脂的以下性质和用途与其含有的双键有关的是( )
| A. | 适量摄入油脂,有助于人体吸收多种脂溶性维生素和胡萝卜素 | |
| B. | 利用油脂在碱性条件下的水解,可以生产甘油和肥皂 | |
| C. | 植物油通过氢化可以制造植物奶油(人造奶油) | |
| D. | 脂肪是有机体组织里储存能量的重要物质 |
4.在CH3COOH溶液中存在:CH3COOH?CH3COO-+H+常温下加水稀释,下列分析正确的是( )
| A. | c(OH-)减小 | B. | c(CH3COO-) 增大 | ||
| C. | pH减小 | D. | $\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$增大 |
5.银锌钮扣电池的两个电极分别是由氧化银与少量石墨组成的活性材料和锌汞合金构成,电解质为氢氧化钾溶液,电极反应为 Zn+2OH--2e-═ZnO+H2O;Ag2O+H2O+2e-═2Ag+2OH-;总反应为:Ag2O+Zn═2Ag+ZnO,下列判断正确的是( )
| A. | 锌为正极,Ag2O为负极 | B. | 锌为阳极,Ag2O为阴极 | ||
| C. | 原电池工作时,负极区PH减小 | D. | 原电池工作时,负极区PH增大 |
 制取氨气并完成喷泉实验(图中夹持装置均已略去).
制取氨气并完成喷泉实验(图中夹持装置均已略去). .
.