题目内容
19.0.2mol有机物和0.4molO2在密闭容器中完全燃烧后的产物为CO2、CO、H2O(气),产物经过浓H2SO4后,质量增加10.8g,再通过灼热的氧化铜充分反应后,质量减轻3.2g,最后气体再通过碱石灰被完全吸收,质量增加17.6g.(1)试通过计算确定该有机物的化学式.
(2)若该有机物恰好与4.6g金属钠完全反应,试确定该有机物的结构简式.
分析 (1)浓硫酸具有吸水性,产物经过浓H2SO4后,质量增加10.8g,说明反应产物中含水10.8g,通过灼热氧化铜,由于发生反应CuO+CO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO2,质量减轻3.2g,结合方程式利用差量法可计算CO的物质的量,通过碱石灰时,碱石灰的质量增加了17.6g可计算总CO2的物质的量,减去CO与CuO反应生成的CO2的质量为有机物燃烧生成CO2的质量,根据元素守恒计算有机物中含有C、H、O的物质的量,进而求得化学式;
(2)结合分子式、与4.6g金属钠完全反应,判断分子中官能团,据此书写结构简式.
解答 解:(1)有机物燃烧生成水10.8g,物质的量为$\frac{10.8g}{18g/mol}$=0.6mol,
令有机物燃烧生成的CO为x,则:
CuO+CO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO2,气体质量减小△m
28g 16g
x 3.2g
所以x=$\frac{28g×3.2g}{16g}$=5.6g,CO的物质的量为$\frac{5.6g}{28g/mol}$=0.2mol.
根据碳元素守恒可知CO与CuO反应生成的CO2的物质的量为0.2mol,质量为0.2mol×44g/mol=8.8g.
有机物燃烧生成的CO2的质量为17.6g-8.8g=8.8g,物质的量为$\frac{8.8g}{44g/mol}$=0.2mol,
根据碳元素守恒可知,1mol有机物含有碳原子物质的量为2mol,
根据氢元素守恒可知,1mol有机物含有氢原子物质的量为$\frac{0.6mol×2}{0.2}$=6mol
根据氧元素守恒可知,1mol有机物含有氧原子物质的量为$\frac{0.6mol+0.2mol+0.2mol×2-0.4mol×2}{0.2}$=2mol,
所以有机物的分子式为C2H6O2.
答:有机物的分子式为C2H6O2;
(2)0.2mol该有机物恰好与4.6g金属钠($\frac{4.6g}{23g/mol}$=0.2mol)完全反应,说明每1个分子含有1个羟基,有机物中含有羟基,有机物的分子式为C2H6O2,所以该有机物的结构简式为CH3OCH2OH.
答:该有机物的结构简式为CH3OCH2OH.
点评 本题考查了有机物分子式、结构简式的确定,侧重于学生的分析、计算能力的考查,题目难度中等,注意掌握常见有机物结构与性质,明确质量守恒定律在确定有机物分子式中的应用方法.

 名校课堂系列答案
名校课堂系列答案| A. | 标准状况下,4.48L Cl2溶于水所得氯水中含氯的微粒总数为0.4NA | |
| B. | 5.6g乙烯和环丁烷(C4H8)的混合气体中含的碳原子数为0.4NA | |
| C. | 常温下,pH=2的盐酸溶液中含有的H+数目为0.02NA | |
| D. | 常温下,1L 0.5mol/L的FeCl3溶液中,所含Fe3+数为0.5NA |
| 反应物 | a+b | c+d | a+d | a+c | b+d |
| 现象 | 白色沉淀 | 白色沉淀 | 白色沉淀 | 白色沉淀 | 无色气体 |
| A. | CH4(g)+2O2(g)═CO2(g)+2H2O(l) | B. | HNO3(aq)+NaOH(aq)═NaNO3(aq)+H2O(l) | ||
| C. | 2H2(g)+O2(g)═2H2O(l) | D. | 2FeCl3(aq)+Fe(s)═3FeCl3(aq) |
| A. | m、n | B. | 3、7 | C. | m-2、10-n | D. | m+2、n+10 |
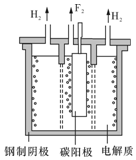 氟是自然界中广泛分布的元素之一.由于氟的特殊化学性质,它和其他卤素在单质及化合物的制备与性质上存在较明显的差异.
氟是自然界中广泛分布的元素之一.由于氟的特殊化学性质,它和其他卤素在单质及化合物的制备与性质上存在较明显的差异.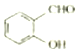 <
<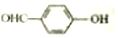
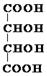 .
.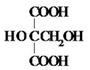 .M的核磁共振氢谱图中有4组吸收峰.
.M的核磁共振氢谱图中有4组吸收峰.