题目内容
3.设NA为阿伏加德罗常数,下列叙述正确的是( )| A. | 0.1 mol•L-1CaCl2溶液中含氯离子数为0.2 NA | |
| B. | 0.1 mol铁粉与过量的氯气完全反应,转移电子数为0.2NA | |
| C. | 标准状况下,2.24 L H2O所含的原子总数为0.3 NA | |
| D. | 常温常压下,17g NH3含有的电子个数为10NA |
分析 A、溶液体积不明确;
B、铁与氯气反应后变为+3价;
C、标况下水为液态;
D、求出氨气的物质的量,然后根据1mol氨气中含10mol电子来分析.
解答 解:A、溶液体积不明确,故溶液中的氯离子的个数无法计算,故A错误;
B、铁与氯气反应后变为+3价,故0.1mol铁粉与氯气反应转移0.3mol电子即0.3NA个,故B错误;
C、标况下水为液态,故不能根据气体摩尔体积来计算其物质的量,故C错误;
D、17g氨气的物质的量为1mol,而1mol氨气中含10mol电子,即10NA个电子,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
13.将装有60mLNO2、NO混合气的量筒倒立于水槽中,反应后气体体积缩小为40mL,则混合气体中NO2和NO的体积比是( )
| A. | 5:3 | B. | 2:3 | C. | 1:1 | D. | 2:1 |
14.煤的直接液化是煤与一种物质作用生成液体燃料的过程,该液体燃料是( )
| A. | 煤油 | B. | 液态煤 | C. | 煤焦油 | D. | 甲醇 |
8.根据下图海水综合利用的工业流程图,判断下列说法正确的是
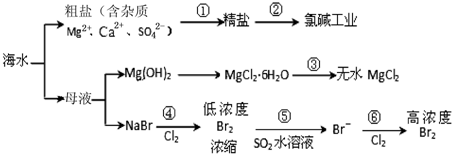
已知:MgCl2•6H2O受热生成Mg(OH)Cl和HCl气体等( )

已知:MgCl2•6H2O受热生成Mg(OH)Cl和HCl气体等( )
| A. | 除去粗盐中杂质(Mg2+、Ca2+、SO42-),加入的药品顺序为:NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸 | |
| B. | 在过程③中将MgCl2•6H2O灼烧即可制得无水MgCl2 | |
| C. | 在过程④、⑥反应中每氧化0.2 mol Br- 需消耗2.24 L Cl2 | |
| D. | 从第④步到第⑥步的目的是为了浓缩富集溴 |
15.下列物质暴露在空气中容易变质的是( )
| A. | 氯化钠 | B. | 氢氧化钠 | C. | 碳酸钠 | D. | 硫酸钠 |
12.32gO2和32gO3比较,下列说法正确的是( )
| A. | 两种气体所含分子数之比为1:1 | |
| B. | 两种气体的摩尔质量之比为1:1 | |
| C. | 两种气体所含原子数之比为1:1 | |
| D. | 两种气体所含的氧原子的摩尔质量之比为2:3 |
18.下列溶液中微粒的物质的量浓度关系正确的是( )
| A. | Ca(ClO)2溶液中:c(Ca2+)>c(ClO-)>c(OH-)>c(H+) | |
| B. | 等体积、等物质的量浓度的NaX和弱酸HX混合:c(Na+ )=c(X-)>c(OH-)=c(H+) | |
| C. | 常温下,将25mL0.2mol/L的盐酸与100mL0.1mol/L的氨水混合,所得溶液中:c(Cl-)>c(NH4+)>c(NH3•H2O)>c(OH-)>c(H+) | |
| D. | 将0.1mol/L的Na2S溶液与0.1mol/L的NaHS溶液等体积混合,所得溶液中:c(S2-)+2c(OH-)=2c(H+)+c(HS-)+3c(H2S) |
