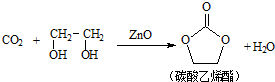题目内容
18.下列溶液中微粒的物质的量浓度关系正确的是( )| A. | Ca(ClO)2溶液中:c(Ca2+)>c(ClO-)>c(OH-)>c(H+) | |
| B. | 等体积、等物质的量浓度的NaX和弱酸HX混合:c(Na+ )=c(X-)>c(OH-)=c(H+) | |
| C. | 常温下,将25mL0.2mol/L的盐酸与100mL0.1mol/L的氨水混合,所得溶液中:c(Cl-)>c(NH4+)>c(NH3•H2O)>c(OH-)>c(H+) | |
| D. | 将0.1mol/L的Na2S溶液与0.1mol/L的NaHS溶液等体积混合,所得溶液中:c(S2-)+2c(OH-)=2c(H+)+c(HS-)+3c(H2S) |
分析 A.Ca(ClO)2溶液中次氯酸根离子水解溶液显碱性,水解程度微弱;
B.等体积、等物质的量浓度的NaX和弱酸HX混合,溶液酸碱性取决于HX的电离和X-离子的水解程度相对大小;
C.将25mL0.2mol/L的盐酸与100mL0.1mol/L的氨水混合反应后得到等浓度的一水合氨和氯化铵溶液,溶液中一水合氨电离大于铵根离子的水解溶液显碱性;
D.将0.1mol/L的Na2S溶液与0.1mol/L的NaHS溶液等体积混合,溶液中存在物料守恒2n(Na)=3n(S),结合电荷守恒和物料守恒计算判断.
解答 解:A.Ca(ClO)2溶液中次氯酸根离子水解溶液显碱性,水解微弱次氯酸根离子浓度大于该离子浓度,溶液中离子浓度大小为:c(ClO-)>c(Ca2+)>c(OH-)>c(H+),故A错误;
B.等体积、等物质的量浓度的NaX和弱酸HX混合,溶液酸碱性取决于HX的电离和X-离子的水解程度相对大小,溶液酸碱性不一定,若电离大于水解,溶液显酸性,若电离小于水解,溶液显碱性,故B错误;
C.将25mL0.2mol/L的盐酸与100mL0.1mol/L的氨水混合反应后得到等浓度的一水合氨和氯化铵溶液,溶液中一水合氨电离大于铵根离子的水解溶液显碱性,溶液中离子浓度大小为:c(NH4+)>c(Cl-)>c(NH3•H2O)>c(OH-)>c(H+),故C错误;
D.将0.1mol/L的Na2S溶液与0.1mol/L的NaHS溶液等体积混合,溶液中存在物料守恒2n(Na)=3n(S),2c(Na+)=3[c(S2-)+c(HS-)+c(H2S)],溶液中存在电荷守恒为:2c(S2-)+c(OH-)+c(HS-)=c(H+)+c(Na+),消去钠离子浓度所得溶液中:c(S2-)+2c(OH-)=2c(H+)+c(HS-)+3c(H2S),故D正确;
故选D.
点评 本题考查了盐类水解原理、弱电解质电离平衡、电解质溶液中电荷守恒和物料守恒,酸碱反应定量分析应用,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 0.1 mol•L-1CaCl2溶液中含氯离子数为0.2 NA | |
| B. | 0.1 mol铁粉与过量的氯气完全反应,转移电子数为0.2NA | |
| C. | 标准状况下,2.24 L H2O所含的原子总数为0.3 NA | |
| D. | 常温常压下,17g NH3含有的电子个数为10NA |
| A. | NaClO是“84消毒液”的有效成分,其水溶液能使有色布条褪色,反应中NaClO表现还原性 | |
| B. | Cl2与烧碱溶液反应的实质是Cl2+OH-═Cl-+ClO-+H2O | |
| C. | 氯气有毒,在通风橱中制备氯气可以消除氯气的污染 | |
| D. | 将Cl2通入淀粉-KI溶液,溶液变蓝色 |
| 序号 | A | B | C | D |
| 物质类型 | 离子化合物 | 共价键直接构成的物质 | 共价分子 | 稀有气体 |
| 代表物质 | NaCl | 金刚石 | 干冰 | Ne |
| 组成晶体的结构微粒 | Na+、Cl- | C | CO2 | Ne |
| 结构微粒间相互作用 | 离子键 | 共价键 | 分子间作用力 | 共价键 |
| A. | A | B. | B | C. | C | D. | D |
| A. | $\frac{16n}{3m-2n}$ | B. | $\frac{32n}{n-m}$ | C. | $\frac{32m}{3n-2m}$ | D. | $\frac{32n}{3n-2m}$ |
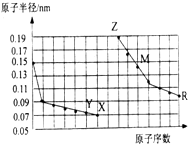
| A. | 简单离子的半径大小比较:Z>Y>X | |
| B. | 气态氢化物稳定性:Y>X>R | |
| C. | 单质的熔点:M>Z | |
| D. | Z单质能从M的盐溶液中置换出单质M |
| A. | 铜与热的稀硫酸:Cu+2H+═Cu2++H2↑ | |
| B. | 在碳酸氢铵稀溶液中加入足量的氢氧化钠稀溶液:NH4++OH-═NH3•H2O | |
| C. | AlCl3溶液滴加过量的氨水:3NH3•H2O+Al3+═Al(OH)3↓+3NH4+ | |
| D. | 氯化亚铁溶液中通入氯气:Fe2++Cl2═Fe3++2Cl- |
| A. | 在标准状况下,22.4L SO3的分子数约为NA个 | |
| B. | 58.5g NaCl溶于1 L水中,所得溶液中溶质的物质的量浓度为1 mol/L | |
| C. | 常温、常压下,48g臭氧含有的氧原子数为3NA | |
| D. | 5.6g Fe与足量的盐酸反应失去的电子数为0.3NA |