题目内容
将不纯的NaOH样品1g(样品含少量Na2CO3和水),放入50mL 2mol?L-1的盐酸中,充分反应后,溶液呈酸性,中和多余的酸又用去40mL 1mol?L-1的NaOH溶液.蒸发中和后的溶液,最终得到多少克固体?
考点:化学方程式的有关计算
专题:
分析:NaOH、Na2CO3均与HCl反应得到NaCl,蒸发得到的最终固体为NaCl,根据Cl元素守恒n(NaCl)=n(HCl),再根据m=nM计算NaCl的质量.
解答:
解:NaOH、Na2CO3均与HCl反应得到NaCl,蒸发得到的最终固体为NaCl,根据Cl元素守恒n(NaCl)=n(HCl)=0.05L×2mol/L=0.1mol,故NaCl的质量为0.1mol×58.5g/mol=5.85g,
答:最终得到5.85g固体.
答:最终得到5.85g固体.
点评:本题考查混合物计算,侧重考查学生分析计算能力,关键是明确最终固体为NaCl,注意利用元素守恒计算计算解答.

练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目
在水溶液中能大量共存,且加入过量稀硫酸时,有气体生成的是( )
| A、Na+、Ag+、CO32-、Cl- |
| B、K+、Ba2+、SO42-、Cl- |
| C、Na+、K+、CO32-、Cl- |
| D、H+、K+、Cl-、HCO3- |
在核电荷数为1~18的原子中,原子的最外层电子数等于次外层电子数的有( )
| A、1种 | B、2种 | C、3种 | D、4种 |
混合气体由N2和CH4组成,测得混合气体在标准状况下的密度为1.00g/L,则混合气体中N2和CH4的体积之比为( )
| A、8:7 | B、1:4 |
| C、4:1 | D、1:1 |
设NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A、在标准状况下,体积为22.4L的物质都是1mol |
| B、在非标状况下,1mol任何气体的体积不可能是22.4L |
| C、在标准状况下,1mol H2O和1mol H2的体积都为22.4L |
| D、同温同压下两种气体,只要它们的分子数相同,所占体积也一定相同 |
设NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A、常温常压下,18克H2O所含电子数为10 NA |
| B、将1mol FeCl3全部化成胶体,其中氢氧化铁胶粒数为NA |
| C、在常温常压下,11.2L氧气所含的原子数目为NA |
| D、标准状况下2.24L的SO3所含的原子数为0.4NA |
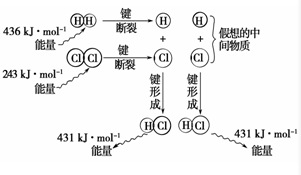 实验测得1mol H2与1mol Cl2反应生成2mol HCl时,放出184.6kJ的热量,其理论分析数据与实验数据略有差异,如图表示上述反应能量变化的理论分析示意图:
实验测得1mol H2与1mol Cl2反应生成2mol HCl时,放出184.6kJ的热量,其理论分析数据与实验数据略有差异,如图表示上述反应能量变化的理论分析示意图: