题目内容
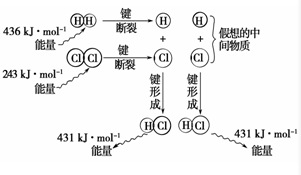 实验测得1mol H2与1mol Cl2反应生成2mol HCl时,放出184.6kJ的热量,其理论分析数据与实验数据略有差异,如图表示上述反应能量变化的理论分析示意图:
实验测得1mol H2与1mol Cl2反应生成2mol HCl时,放出184.6kJ的热量,其理论分析数据与实验数据略有差异,如图表示上述反应能量变化的理论分析示意图:(1)化学键断裂需要
(2)图中表示了吸收和释放的能量,其中释放的能量共
(3)该反应的反应物的总能量
(4)用图示数据计算其反应热,写出该反应的热化学方程式
考点:反应热和焓变
专题:
分析:化学反应的实质是旧键的断裂和新键的形成,断裂旧键要吸收能量,形成新键要放出能量,反应热=反应物的总键能=生成物的总键能,以此解答该题.
解答:
解:(1)化学键断裂需要吸收能量,故答案为:吸收;
(2)形成化学键放出热量:2×431kJ=862kJ,故答案为:862;
(3)该反应中反应物的总能量大于生成物的总能量,属于放热反应,故答案为:大于;放热;
(4)化学键断裂吸收热量:436kJ+243kJ=679kJ,
形成化学键放出热量:2×431kJ=862kJ,
热化学方程式是:H2(g)+Cl2(g)═2HCl(g)△H=(436kJ/mol+243kJ/mol)-2×431kJ/mol=-183kJ/mol,
故答案为:H2(g)+Cl2(g)═2HCl(g)△H=183kJ/mol.
(2)形成化学键放出热量:2×431kJ=862kJ,故答案为:862;
(3)该反应中反应物的总能量大于生成物的总能量,属于放热反应,故答案为:大于;放热;
(4)化学键断裂吸收热量:436kJ+243kJ=679kJ,
形成化学键放出热量:2×431kJ=862kJ,
热化学方程式是:H2(g)+Cl2(g)═2HCl(g)△H=(436kJ/mol+243kJ/mol)-2×431kJ/mol=-183kJ/mol,
故答案为:H2(g)+Cl2(g)═2HCl(g)△H=183kJ/mol.
点评:本题考查了化合反应与能量变化,题目难度不大,本题注意从键能角度计算反应热的方法,学习中注意相关知识的把握.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案
相关题目
下列有关实验原理、方法和结论都正确的是( )
| A、向相同浓度的NaBr、NaI溶液中滴加硝酸银溶液,先出现黄色沉淀,说明KSP (AgI)>KSP (AgBr) |
| B、在3mL苯酚溶液中滴入几滴溴水,没有沉淀生成,说明苯酚没有和溴水反应 |
| C、向某有机物中加入氢氧化钠溶液、加热,然后向其中加入硝酸银溶液,发现产生了白色沉淀,说明该有机物中含有氯元素 |
| D、室温下向苯和少量苯酚的混合溶液中加入适量NaOH溶液,振荡、静置后分液,可除去苯中少量苯酚 |
某一反应物的浓度是1.0mol?L-1,经过10s后,它的浓度变成了0.2mol?L-1,在这10s内,它的反应速率为( )
| A、0.08 |
| B、0.08 mol?(L?s)-1 |
| C、0.04 |
| D、0.04 mol?(L?s)-1 |
烧过菜的铁锅未及时洗涤(残液中含有食盐等),第二天便出现红棕色锈斑,下列反应中不属于上述整个过程中可能发生的变化的是( )
| A、2H2O+O2+4e→4OH- |
| B、Fe2++2OH-→Fe(OH)2↓ |
| C、Fe-3e→Fe3+ |
| D、4Fe(OH)2+O2+2H2O→4Fe(OH)3↓ |
2014年诺贝尔化学奖近日揭晓,获奖者为埃里克?贝齐格、威廉?莫纳和斯特凡?黑尔,他们的获奖理由是在超分辨率荧光显微技术领域取得的成就,他们巧妙地绕过了经典光学的“束缚”,开创性的使光学显微镜能够窥探纳米世界,下列说法不正确的是( )
| A、该研究成果允许人类观察病毒以至细胞内的蛋白质,例如可用于观察帕金森症、脑退化症和亨廷顿病患者体内的蛋白变化等 |
| B、1纳米=10-9m |
| C、将稀FeCl3溶液滴入沸水并煮沸一段时间,可得到红褐色液体,该液体具有丁达尔效应 |
| D、在硅酸胶体中加入NaOH溶液,先出现浑浊后澄清 |
下列离子方程式正确的是( )
| A、等物质的量浓度的FeI2溶液与溴水等体积混合2Fe2++2I-+2Br2=2Fe3++I2+4Br- |
| B、氢氧化铁溶于氢碘酸中:Fe(OH)3+3H+═Fe3++3H2O |
| C、次氯酸钙溶液中通入过量二氧化碳 Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO |
| D、向硫酸氢钠溶液中滴加Ba(OH)2溶液恰好至中性2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O |
 某研究性小组用0.20mol/L NaOH溶液滴定未知浓度的白醋(指示剂为酚酞).
某研究性小组用0.20mol/L NaOH溶液滴定未知浓度的白醋(指示剂为酚酞).