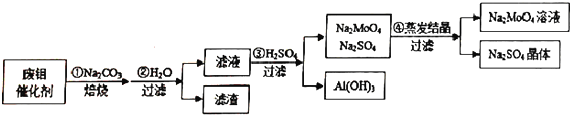
题目内容
18.已知A、B、C、D为气体,其中A、B为单质;E、F为固体,G是氯化钙,它们之间的转换关系如图所示: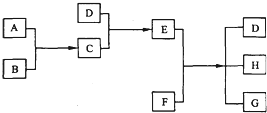
(1)D的化学式(分子式)NH3,E的电子式
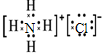
(2)C和的D反应生成E的实验现象有白烟生成.
(3)E和F反应生成D、H和G的化学方程式2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
(4)工业生产D的化学方程式是N2+3H2$?_{催化剂}^{高温高压}$2NH3.
分析 由“D+C→E,且C、D为气体;E为固体”可推知C、D可能为NH3、HCl;E为NH4Cl,再结合“E+F→D+H+G,G是氯化钙”进一步推知D为NH3、F为Ca(OH)2,H为水,所以C是HCl,A、B分别是H2和Cl2,以此解答该题.
解答 解:由“D+C→E,且C、D为气体;E为固体”可推知C、D可能为NH3、HCl;E为NH4Cl,再结合“E+F→D+H+G,G是氯化钙”进一步推知D为NH3、F为Ca(OH)2,H为水,所以C是HCl,A、B分别是H2和Cl2,
(1)由以上分析可知,D的化学式是NH3;E的化学式是NH4Cl,氯化铵为离子化合物,氯离子中的最外层电子应该标出,正确的电子式为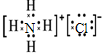 ,
,
故答案为:NH3;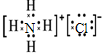 ;
;
(2)C、D为NH3、HCl,C和D反应的化学方程式是NH3+HCl=NH4Cl,可观察到有白烟生成,
故答案为:有白烟生成;
(3)氯化铵和氢氧化钙反应生成氯化钙、氨气和水,反应的化学方程式为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(4)D为氨气,工业上用氮气与氢气反应生成氨气,反应的化学方程式为:N2+3H2$?_{催化剂}^{高温高压}$2NH3,
故答案为:N2+3H2$?_{催化剂}^{高温高压}$2NH3.
点评 本题考查无机物的推断,侧重NH3的实验室制法,NH3、HCl的性质等知识的考查,注意把握常见反应的特点,难度不大,试题培养了学生的分析能力及逻辑推理能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
9.将1.0体积的两种烃的混合气体在氧气中充分燃烧,生成2.4体积的CO2和2.8体积的水蒸气(同温同压下),则混合物中的两种烃可能是( )
| A. | 乙烯和丙烷 | B. | 甲烷和丙烷 | C. | 甲烷和丙烯 | D. | 乙烯和丁烷 |
10.下列说法正确的是( )
| A. | 自然界中所有金属都以化合态形式存在 | |
| B. | 化学史上,金、银、铜发现较早,钾、钠、铝发现较迟是因为前者自然界含量高,后者含量低 | |
| C. | 废旧金属处理的最好办法是深埋 | |
| D. | 冶炼金属的一般步骤是:浮选富集→冶炼→精炼 |
7.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA | |
| B. | 标准状况下,11.2L苯中含有分子的数目为0.5NA | |
| C. | 常温常压下,14g由N2与CO组成的混合气体含有的原子数目为NA | |
| D. | 物质的量浓度为1mol/L100mlHCl溶液中含0.1molHCl分子 |
16.下列化学用语或图示表达正确的是( )
| A. | CO2的电子式: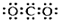 | B. | Na+的结构示意图: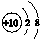 | ||
| C. | 氯离子:Cl | D. | 中子数为20的氯原子:${\;}_{17}^{37}$Cl |