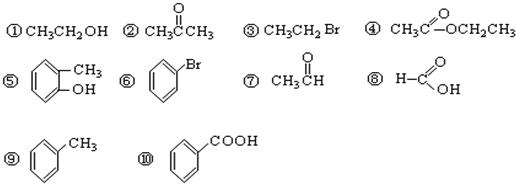
题目内容
13.钼酸钠(Na2MoO4)具有广泛的用途.可做新型水处理荆、优良的金属缓蚀剂及可用于局部过热的循环水系统;Al(OH)3工业和医药上都具有重要用途.现从某废钼催化剂(主要成分MoO3、Al2O3、Fe2O3等)中回收Na2MoO4和Al(OH)3,其工艺如图: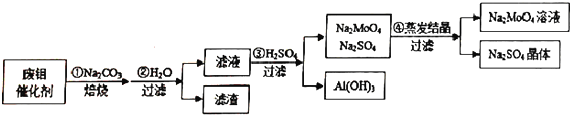
回答下列问题:
(1)已知MoO3、Al2O3与SiO2相似,均能在高温下跟Na2CO3发生类似反应,试写出MoO3与Na2CO3反应的化学方程式:MoO3+Na2CO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2MoO4+CO2↑.
(2)第②步操作所后的滤液中,溶质有Na2MoO4、NaAlO2和过量的Na2CO3;检验第②步操作所得滤渣中含有三价铁的方法是取少量滤渣洗涤液于试管中滴加几滴KSCN溶液,若溶液变红,则证明含三价铁.
(3)第③步操作H2SO4需要适量,通常是通过测溶液的pH来调控H2SO4的用量;与Na2SO4相比,Na2MoO4的溶解度受温度的影响变化较小(填“较大”或“较小”).
(4)利用铝热反应可回收金属钼.将所得钼酸钠溶液用酸处理得到沉淀,再加热可得MoO3.写出MoO3发生铝热反应的化学方程式:4Al+2MoO3$\frac{\underline{\;高温\;}}{\;}$2Mo+2Al2O3.
(5)取废钼催化剂5.00g,加入5.30gNa2CO3(足量),经上述实验操作后,最终得到2.34g Al(OH)3和6.39gNa2SO4晶体,则废钼催化剂中Al2O3、MoO3的物质的量的比值为3:1.
分析 MoO3、Al2O3与Na2CO3的反应和SiO2与Na2CO3的反应相似,加入碳酸钠焙烧时可生成Na2MoO4和NaAlO2,加入水溶解后出去杂质,加入硫酸浸泡,可生成氢氧化铝沉淀,过滤后滤液中存在硫酸钠和Na2MoO4,二者溶解度不同,经蒸发结晶可得到Na2SO4晶体和Na2MoO4,
(1)加入碳酸钠焙烧时可生成Na2MoO4和NaAlO2,MoO3与Na2CO3反应生成Na2MoO4和二氧化碳;
(2)高温条件下,氧化铝和碳酸钠反应生成NaAlO2,检验第②步操作所得滤渣中含有三价铁是利用铁离子结合硫氰酸钾溶液中硫氰酸根离子形成血红色溶液设计实验检验;
(3)溶液中加入硫酸适量避免氢氧化铝溶解,一般利用测定溶液PH控制,转化关系分析可知④蒸发结晶得到硫酸钠晶体和Na2MoO4溶液,说明硫酸钠溶解度随温度变化大;
(4)MoO3发生铝热铝反应,高温下和铝反应生成钼和氧化铝;
(5)加入稀硫酸后,滤渣为Al(OH)3,滤液中含有Na2SO4和Na2MoO4,已知:n(Na2CO3)=$\frac{5.30g}{106g/mol}$=0.05mol,n(Na2SO4)=$\frac{6.39g}{142g/mol}$=0.045mol,则Na2MoO4,由Na守恒可知n(Na2MoO4)=0.005mol,据此算出MoO3的物质的量为0.005mol,2.34g Al(OH)3的物质的量为$\frac{2.34g}{78g/mol}$=0.03mol,据此算出Al2O3的物质的量为0.015mol,然后可确定它们的比值.
解答 解:(1)MoO3、Al2O3与Na2CO3的反应和SiO2与Na2CO3的反应相似,加入碳酸钠焙烧时可生成Na2MoO4和NaAlO2,MoO3与Na2CO3反应的化学方程式为MoO3+Na2CO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2MoO4+CO2↑,
故答案为:MoO3+Na2CO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2MoO4+CO2↑;
(2)高温条件下,氧化铝和碳酸钠反应生成NaAlO2,滤液中含有焙烧后生成Na2MoO4、NaAlO2以及过量的Na2CO3,检验第②步操作所得滤渣中含有三价铁,取少量滤渣洗涤液于试管中滴加几滴KSCN溶液,若溶液变红,则证明含三价铁,
故答案为:NaAlO2;取少量滤渣洗涤液于试管中滴加几滴KSCN溶液,若溶液变红,则证明含三价铁;
(3)第③步操作H2SO4需要适量,避免氢氧化铝溶解,通常是通过测溶液的pH来调控H2SO4的用量,转化关系中④蒸发结晶溶液得到硫酸钠晶体和Na2MoO4溶液,与Na2SO4相比,Na2MoO4的溶解度受温度的影响变化较小,硫酸钠溶解度收温度影响大,先析出晶体,
故答案为:测溶液的pH;较小;
(4)MoO3发生铝热铝反应,高温下和铝反应生成钼和氧化铝,反应的化学方程式为:4Al+2MoO3$\frac{\underline{\;高温\;}}{\;}$2Mo+2Al2O3,
故答案为:4Al+2MoO3$\frac{\underline{\;高温\;}}{\;}$2Mo+2Al2O3;
(5)加入稀硫酸后,滤渣为Al(OH)3,滤液中含有Na2SO4和Na2MoO4,已知:n(Na2CO3)=$\frac{5.30g}{106g/mol}$=0.05mol,n(Na2SO4)=$\frac{6.39g}{142g/mol}$=0.045mol,则Na2MoO4,由Na守恒可知n(Na2MoO4)=0.005mol,据此算出MoO3的物质的量为0.005mol,2.34g Al(OH)3的物质的量为$\frac{2.34g}{78g/mol}$=0.03mol,据此算出Al2O3的物质的量为0.015mol,所以Al2O3、MoO3的物质的量的比值为0.015mol:0.005mol=3:1,
故答案为:3:1.
点评 本题考查物质的分离、提纯,为高考常见题型和高频考点,侧重于学生的分析能力和实验能力的考查,注意把握实验的原理和物质的性质,为解答该题的关键,难度中等.

| A. | 甲烷 | B. | 乙烯 | C. | 二氧化硫 | D. | 碘化钾 |
| A. | 6g SiO2所含分子数为0.1NA,化学键总数为0.4NA | |
| B. | 将2mL 0.5mol/L Na2SiO3溶液滴入稀盐酸中制得H2SiO3胶体,所含胶粒数为0.001NA | |
| C. | 常温常压下,32gO2和O3的混合气体中含有的氧原子数为2NA | |
| D. | 25℃时,PH=13的Ba(OH)2溶液中含有OH-的数目为0.1NA |
| A. | 向带有氧化膜的铝片中加入盐酸 | |
| B. | 向NaHCO3溶液中加入一定质量的Na2O2粉末 | |
| C. | 向漂白粉浊液中通入过量CO2 | |
| D. | 向NaOH溶液中加入过量AlCl3 |