题目内容
16.已知Na2O2能与CO2、H2O反应,将8.4g的CO2和H2O混合气体,通入足量的Na2O2中,可得O2(标准状况)2.8L,求原混合气体中CO2与H2O的物质的量.分析 根据n=$\frac{m}{M}$计算氧气物质的量,由2CO2+2Na2O2=2Na2CO3+O2,2H2O+2Na2O2=4NaOH+O2,可知二氧化碳和水蒸气都是2mol反应生成1mol氧气,生成氧气物质的量=$\frac{2.8L}{22.4L/mol}$=0.125mol,可计算混合气体总物质的量,设CO2物质的量为xmol,水蒸气物质的量为(0.125×2-x)mol,利用二者质量列方程计算.
解答 解:=$\frac{2.8L}{22.4L/mol}$=0.125mol,由2CO2+2Na2O2=2Na2CO3+O2,2H2O+2Na2O2=4NaOH+O2,可知二氧化碳和水蒸气都是2mol反应生成1mol氧气,故混合气体物质的量为0.125mol×2=0.25mol,
设CO2物质的量为xmol,水蒸气物质的量为(0.25-x)mol,则:
44x+(0.25-x)×18=8.4g;
解得:x=0.15mol,
所以水的物质的量=0.25mol-0.15mol=0.1mol,
答:原混合气体中CO2为0.15 mol,H2O为0.1 mol.
点评 本题考查混合物计算、化学方程式的计算,难度不大,明确发生的反应即可解答.

练习册系列答案
相关题目
6.A、B均为短周期主族元素,其原子的部分电离能(In,单位为kJ•mol-1)数据如表所示:
A的最高化合价为+5,基态B原子的电子排布式为1s22s22p63s23p3,A的电负性>B的电负性(填“>”、“<”或“=”).
| 序号 | I1 | I2 | I3 | I4 | I5 | I6 | I7 | |
| A的电离能 | 1402 | 2856 | 4578 | 7475 | 9445 | 53267 | … | |
| B的电离能 | 1012 | 1907 | 2914 | 4964 | 6274 | 21267 | 25431 | |
| 序号 | I8 | I9 | I10 | I11 | I12 | I13 | I14 | … |
| B的电离能 | 29872 | 35905 | 40950 | 46261 | 54110 | 59024 | 271791 | … |
7.从中草药茵陈蒿中可提取出一种利胆有效成分--对羟基苯乙酮,结构简式为: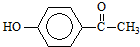 .这是一种值得进一步研究应用的药物.推测该药物不具有的化学性质是( )
.这是一种值得进一步研究应用的药物.推测该药物不具有的化学性质是( )
 .这是一种值得进一步研究应用的药物.推测该药物不具有的化学性质是( )
.这是一种值得进一步研究应用的药物.推测该药物不具有的化学性质是( )| A. | 能跟氢氧化钠反应 | |
| B. | 能跟浓溴水反应 | |
| C. | 能跟碳酸氢钠反应 | |
| D. | 在催化剂存在时能被还原成含醇羟基的物质 |
4.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 5.6 g铁粉在0.1mol氯气中充分燃烧,转移电子数为0.3NA | |
| B. | 1 mol Na2O2与足量H2O充分反应,转移的电子数为2NA | |
| C. | 7.8gNa2O2中含有的阴离子数等于0.1NA | |
| D. | 标况下,2.24LH2O所含分子数为0.1NA |
1.根据反应:
①I2+SO2+2H2O═H2SO4+2HI
②2FeCl3+2HI═2FeCl2+I2+2HCl
③2FeCl2+Cl2═2FeCl3
可知:I-、Fe2+、Cl-、SO2的还原性由强到弱的顺序是( )
①I2+SO2+2H2O═H2SO4+2HI
②2FeCl3+2HI═2FeCl2+I2+2HCl
③2FeCl2+Cl2═2FeCl3
可知:I-、Fe2+、Cl-、SO2的还原性由强到弱的顺序是( )
| A. | SO2>I->Fe2+>Cl- | B. | Cl->Fe2+>SO2>I- | C. | Fe2+>I->Cl->SO2 | D. | I->Fe2+>Cl->SO2 |
8.现有一瓶物质甲和乙的混合物,已知甲和乙的某些性质如表所示.据此,将甲和乙分离的最佳方法是( )
| 物质 | 熔点(℃) | 沸点(℃) | 密度 (g•cm-3) | 二者溶解性关系 |
| 甲 | -98 | 57.5 | 1.93 | 互不相溶 |
| 乙 | -84 | 77 | 0.90 |
| A. | 蒸馏 | B. | 蒸发 | C. | 过滤 | D. | 分液 |
5.在相同的温度和压强下,二氧化碳和笑气(化学式为N2O)的体积相同,则下列它们一定相同的是( )
①分子数;②原子数; ③密度;④质量;⑤物质的量.
①分子数;②原子数; ③密度;④质量;⑤物质的量.
| A. | 只有①⑤ | B. | 只有①②④⑤ | C. | 只有②③④⑤ | D. | ③②④⑤① |
 CaCl2的质量之比为______,若要取出含1 mol Cl-的该混合物,应称取该混合物的质量为________g。
CaCl2的质量之比为______,若要取出含1 mol Cl-的该混合物,应称取该混合物的质量为________g。