题目内容
下列叙述中正确的是( )
| A、乙醇和丙三醇互为同系物 |
| B、16gCH4和18gNH4+所含的质子数相等 |
| C、32S和33S的核外电子数相等,属于同一种核素 |
| D、质量相等,体积不等的CO和C2H4的分子数相等 |
考点:芳香烃、烃基和同系物,同位素及其应用,阿伏加德罗定律及推论
专题:基本概念与基本理论
分析:A、乙醇和丙三醇所含羟基数目不同,不是同系物;
B、1molCH4含有10mol质子,1molNH4+含有11mol质子;
C、质子数相同中子数不同的同一元素的不同原子互称同位素;
D、CO和C2H4的摩尔质量相等,带入n=
.
B、1molCH4含有10mol质子,1molNH4+含有11mol质子;
C、质子数相同中子数不同的同一元素的不同原子互称同位素;
D、CO和C2H4的摩尔质量相等,带入n=
| m |
| M |
解答:
解:A、乙醇和丙三醇所含羟基数目不同,不是同系物,故A错误;
B、16gCH4和18gNH4+的物质的量均为1mol,CH4含有10mol质子,NH4+含有11mol质子,故B错误;
C、32S与33S都是由硫元素组成不同核素,互为同位素,故C错误;
D、CO和C2H4的相对分子质量相等,摩尔质量相等,因此质量相等的两种气体的物质的量相等,分子数相等,故D正确;
故选D.
B、16gCH4和18gNH4+的物质的量均为1mol,CH4含有10mol质子,NH4+含有11mol质子,故B错误;
C、32S与33S都是由硫元素组成不同核素,互为同位素,故C错误;
D、CO和C2H4的相对分子质量相等,摩尔质量相等,因此质量相等的两种气体的物质的量相等,分子数相等,故D正确;
故选D.
点评:本题考查原子组成与结构、同位素等,难度不大,需要注意几个关系式,即质子数+中子数=质量数、质子数=核外电子数=核电荷数=原子序数.

练习册系列答案
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目
下列物质在一定条件下,可与CH4发生取代反应的是( )
| A、氧气 |
| B、溴水 |
| C、氯气 |
| D、酸性KMnO4溶液 |
已知:乙醇可被强氧化剂氧化为乙酸. 可经三步反应制取
可经三步反应制取  ,发生反应的类型依次是( )
,发生反应的类型依次是( )
 可经三步反应制取
可经三步反应制取  ,发生反应的类型依次是( )
,发生反应的类型依次是( )| A、水解反应、加成反应、氧化反应 |
| B、加成反应、水解反应、氧化反应 |
| C、水解反应、氧化反应、加成反应 |
| D、加成反应、氧化反应、水解反应 |
某种甜味剂A的甜度是蔗糖的200倍,由于它热值低、口感好、副作用小,已在90多个国家广泛使用.A的结构简式如图下列有关A的叙述中正确的是( )


| A、A的分子式为:C14H13O5N2 |
| B、A可以发生水解反应、中和反应、加成反应、消去反应 |
| C、A物质完全水解的产物中,一定含有醇类 |
| D、在一定条件下,1molA最多能与1L 2mol?L-1NaOH溶液反应 |
Al与重氢氧化钠(NaOD)的水溶液反应,其中水中不含重氢.下列说法正确的是( )
| A、生成的氢气中只含有H2 |
| B、生成的氢气中只含有D2 |
| C、生成的氢气中含有H2、HD、D2 |
| D、以上判断都不正确 |
根据反应式:(1)2Fe3++2I-=2Fe2++I2 (2)Br2+2Fe2+=2Br-+2Fe3+可判断离子的还原性由强到弱的顺序是( )
| A、Br-、Fe2+、I- |
| B、Br-、I-、Fe2+ |
| C、I-、Fe2+、Br- |
| D、Fe2+、I-、Br- |
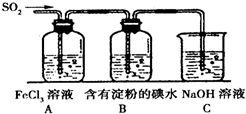 为探究SO2气体的还原性某兴趣小组设计了如装置图:
为探究SO2气体的还原性某兴趣小组设计了如装置图: