题目内容
某无色溶液中只可能含有①Na+、②Ba2+、③Cl一、④I一、⑤SO32一、⑥SO42一 离子中的若干种(忽略水电离出的H+、OH一),依次进行下列实验,且每步所加试剂均过量,观察到现象如下表.下列结论正确的是( )
| 步骤 | 操作 | 现象 |
| ① | 用pH试纸检验 | 溶液的pH大于7 |
| ② | 向溶液中滴加氯水,再加入CCl4振荡,静置 | CCl4层呈紫红色 |
| ③ | 向所得水溶液中加入Ba(NO3)2溶液和稀HNO3 | 有白色沉淀产生 |
| ④ | 过滤,向滤液中加入AgNO3溶液和稀HNO3 | 有白色沉淀产生 |
| A、肯定含有的离子是③④⑤ |
| B、肯定没有的离子是②⑤ |
| C、不能确定的离子是③⑥ |
| D、可能含有的离子是①⑥ |
考点:物质的检验和鉴别的实验方案设计
专题:物质检验鉴别题
分析:由①可知,溶液呈碱性,是含有弱酸阴离子,只有亚硫酸根离子,则不可能含Ba2+;
由②中CCl4层呈紫红色可知,含I-离子;
由③可知,白色沉淀为硫酸钡,一定含SO32-,可能含有SO42-离子;
由④可知,白色沉淀为AgCl,但由于步骤②加入了氯离子,所以原溶液是否含氯离子不能确定,以此来解答.
最后根据电荷守恒确定电解质溶液中的阳离子的存在.
由②中CCl4层呈紫红色可知,含I-离子;
由③可知,白色沉淀为硫酸钡,一定含SO32-,可能含有SO42-离子;
由④可知,白色沉淀为AgCl,但由于步骤②加入了氯离子,所以原溶液是否含氯离子不能确定,以此来解答.
最后根据电荷守恒确定电解质溶液中的阳离子的存在.
解答:
解:由①可知,溶液呈碱性,是含有弱酸阴离子,只有亚硫酸根离子,则不可能含Ba2+;
由②中CCl4层呈紫红色可知,含I-离子;
由③可知,白色沉淀为硫酸钡,一定含SO32-,可能含有SO42-离子;
由④可知,白色沉淀为AgCl,但由于步骤②加入了氯离子,所以原溶液是否含氯离子不能确定;
根据以上分析溶液中一定含有SO32-、I-,一定没有Ba2+;
由电荷守恒可知,溶液中一定含有阳离子为Na+;
所以溶液中一定存在的离子是①④⑤;不能确定的是③Cl-、⑥SO42-;
故选C.
由②中CCl4层呈紫红色可知,含I-离子;
由③可知,白色沉淀为硫酸钡,一定含SO32-,可能含有SO42-离子;
由④可知,白色沉淀为AgCl,但由于步骤②加入了氯离子,所以原溶液是否含氯离子不能确定;
根据以上分析溶液中一定含有SO32-、I-,一定没有Ba2+;
由电荷守恒可知,溶液中一定含有阳离子为Na+;
所以溶液中一定存在的离子是①④⑤;不能确定的是③Cl-、⑥SO42-;
故选C.
点评:本题考查物质的鉴别和检验,涉及化学反应与现象、萃取操作、离子共存的判断等知识,注意电荷守恒的应用,关键是先肯定离子存在,再否定不共存的离子,题目难度不大.

练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目
有关有机物的说法正确的是( )
| A、石油分馏可以获得重要的有机化工原料乙烯 |
| B、乙醇、乙酸、乙酸乙酯可用饱和氢氧化钠溶液鉴别 |
| C、乙烷和苯所含的碳碳键不同,但都能发生氧化反应和取代反应 |
| D、糖类、油脂和蛋白质都是人体必需的营养物质,它们的组成元素相同 |
将一定质量的铁、氧化铁、氧化铜的混合物粉末放入100mL 4.40mol/L盐酸中,充分反应后产生896mL H2(标准状况),残留固体1.28g.过滤,滤液中无Cu2+.将滤液加水稀释到200mL,测得其中c(H+)为0.400mol/L.则原混合物中氧化铁的质量是( )
| A、2.4g | B、3.36g |
| C、5.60g | D、6.4g |
下列物质在一定条件下,可与CH4发生取代反应的是( )
| A、氧气 |
| B、溴水 |
| C、氯气 |
| D、酸性KMnO4溶液 |
人类生活离不开化学知识,下列叙述不正确的是( )
| A、臭氧是饮用水的理想消毒剂之一,因为它杀菌能力强且不影响水质 |
| B、因患“禽流感”而被捕杀的家禽尸体常用生石灰处理 |
| C、医疗上常用体积分数为75%的酒精进行皮肤消毒 |
| D、食品加工、消毒、防腐常使用福尔马林 |
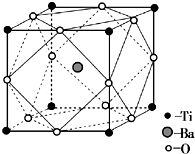 钛被誉为“未来世纪的金属”.试回答下列问题:
钛被誉为“未来世纪的金属”.试回答下列问题: