��Ŀ����
1����Ԫ������Ҫ�ķǽ���Ԫ�أ���Ҫ��ش��������⣮��1����ס���������Ϊ2L���ܱ������У��ֱ����0.6molN2��1.6molH2��������Ӧ��N2��g��+3H2��g��?2NH3��g����H��0�����������¶�ΪT1�������·�Ӧ���ﵽƽ��ʱNH3�����ʵ���Ϊ0.8mol�����������¶�ΪT2�������·�Ӧ���ﵽƽ��ʱN2�����ʵ���Ϊ0.1mol����T1��T2����������������������з�Ӧ��ƽ�ⳣ��K=200��
��2�������ڴ�����ȼ�գ�����һ�ֵ��ʺ�ˮ����ѧ�����ô�ԭ������Ƴɰ���--����ȼ�ϵ�أ���ͨ�백���ĵ缫�ڼ��������·�����Ӧ�ĵ缫��ӦʽΪ2NH3-6e-+6OH-=N2+6H2O��
��3��NOx�Ǵ�����Ⱦ�����NOx��һ�ַ��������ü������ԭNOx��
��CH4 ��g��+4NO2��g���T4NO��g��+CO2��g��+2H2O ��g����H1=-574kJ/mol
��CH4 ��g��+2NO2��g���TN2��g��+CO2��g��+2H2O ��g����H2=-867kJ/mol
����4.48LCH4��ԭNO����N2����ų�������Ϊ232kJ���������������Ϊ��״���£�
��4��HNO3��As2S3�ܷ�����Ӧ��As2S3+10HNO3�T2H3AsO4+3S+10NO2��+2H2O����Ӧ�б�������Ԫ��ΪAs��S�����÷�Ӧ��ת�Ƶĵ��ӵ����ʵ���Ϊ5molʱ�������ɵ�Sȫ��ת��ΪŨH2SO4��Ȼ����������ͭ�ڼ��������·�Ӧ����ͭ����a������ţ���
a��С��0.75mol b������0.75mol c������0.75mol d����ȷ��
��5����0.1mol�����ֱ�ͨ��1L pH=1�����ᡢ����ʹ�����Һ�У���ȫ��Ӧ��������Һ��NH4+���ӵ�Ũ�ȷֱ�Ϊc1��c2��c3����������Ũ�ȴ�С�Ĺ�ϵΪc1=c2��c3����c1��c2��c3�ͣ�������=��ʾ������֪�������Һ�����ԣ�������CH3COOH ��ka=1��10-5mol•L-1 ������¶���0.1mol•L-1 NH4Cl����Һ��pHΪ5��
���� ��1�����������з�Ӧ����ʼ����ͬ�������ͬ�����������¶�ΪT1�������·�Ӧ���ﵽƽ��ʱNH3�����ʵ���Ϊ0.8mol�����������¶�ΪT2�������·�Ӧ���ﵽƽ��ʱN2�����ʵ���Ϊ0.1mol�����ĵ������ʵ���=0.6mol-0.1mol=0.5mol�����ɰ������ʵ���1mol��˵���ҷ�Ӧ����Ӧ���г̶ȴ�Ӧ�Ƿ��ȷ�Ӧ�������¶�Խ�ͣ���Ӧ������г̶ȴ������ʽ����ƽ��Ũ�ȣ�ƽ�ⳣ��K=$\frac{������ƽ��Ũ���ݴη��˻�}{��Ӧ��ƽ��Ũ���ݴη��˻�}$��
��2����ȼ�ϵ���У�ȼ������������ͨ�백���ĵ缫�Ǹ��������������°���ʧ�������ɵ�������ϵ���غ��ԭ���غ���ƽ��д�缫��Ӧ��
��3�������Ȼ�ѧ����ʽ��˹���ɼ���Ŀ���Ȼ�ѧ����ʽ�õ��ʱ䣬��״����4.48LCH4���ʵ���=$\frac{4.48L}{22.4L/mol}$=0.2mol������Ȼ�ѧ����ʽ������ϵ���㣻
��4��������ԭ��Ӧ��Ԫ�ػ��ϼ����ߵ���������ԭ����������������ѧ����ʽ�������ת�������õ���Ӧ�����������ʵ�������Ԫ���غ�õ��������ʵ�����Ũ���������ͭ��Ӧ�淴Ӧ���У�Ũ�ȼ�С����Ϊϡ���������ͭ����������Ӧ��
��5��pH=1�Ĵ����д����Ũ�ȴ���0.1mol/L����ͨ��0.1mol������Ӧ������ʣ�࣬��������������������笠����ӵĵ��룬���������������ǡ�÷�Ӧ��
�������Һ�����ԣ���һˮ�ϰ��ʹ���ĵ��볣����ͬ��������CH3COOH��Ka=1��10-5 mol•L-1������NH3•H2O�ĵ��볣��Ϊ1��10-5 mol•L-1��Ka=$\frac{[N{{H}_{4}}^{+}][{H}^{+}]}{[N{H}_{3}��{H}_{2}O]}$��Kh=$\frac{Kh}{Ka}$=1��10-9���ݴ˼��㣮
��� �⣺��1����ס���������Ϊ2L���ܱ������У��ֱ����0.6molN2��1.6molH2��������Ӧ��N2��g��+3H2��g��?2NH3��g����H��0�����������¶�ΪT1�������·�Ӧ���ﵽƽ��ʱNH3�����ʵ���Ϊ0.8mol�����������¶�ΪT2�������·�Ӧ���ﵽƽ��ʱN2�����ʵ���Ϊ0.1mol�����ݻ�ѧ����ʽ����õ����ĵ������ʵ���=0.6mol-0.1mol=0.5mol�����ɰ������ʵ���1mol��˵���ҷ�Ӧ����Ӧ���г̶ȴ�Ӧ�Ƿ��ȷ�Ӧ�������¶ȣ�ƽ��������У����������з�Ӧ���¶ȵ��ڼ������е��¶ȣ�T1��T2�������¶ȵͷ�Ӧ���г̶ȴ�ƽ�ⳣ����
���ݻ�ѧƽ������ʽ��ʽ��������������ʵ�ƽ��Ũ�ȣ���ʼŨ��c��N2��=$\frac{0.6mol}{2L}$=0.3mol/L��c��H2��=$\frac{1.6mol}{2L}$=0.8mol/L��ƽ��ʱc��NH3��=$\frac{0.8mol}{2L}$=0.4mol/L
N2��g��+3H2��g��?2NH3��g��
��ʼ����mol/L�� 0.3 0.8 0
�仯����mol/L�� 0.2 0.6 0.4
ƽ������mol/L�� 0.1 0.2 0.4
K=$\frac{0��{4}^{2}}{0.1��0��{2}^{3}}$=200��
�ʴ�Ϊ������200��
��2����ȼ�ϵ���У�ȼ������������ͨ�백���ĵ缫�Ǹ��������������£��õ缫������Ӧ�ĵ缫��ӦʽΪ2NH3-6e-+6OH-=N2+6H2O��
�ʴ�Ϊ��2NH3-6e-+6OH-=N2+6H2O��
��3������CH4��g��+4NO2��g���T4NO��g��+CO2��g��+2H2O��g����H1=-574kJ•mol-1
��CH4��g��+2NO2��g���TN2��g��+CO2��g��+2H2O��g����H3=-867kJ•mol-1
CH4��g��+4NO��g���T2N2��g��+CO2��g��+2H2O��g����H2
���ݸ�˹���ɼ��㣬�ڡ�2-�ٵõ�CH4��g��+4NO��g���T2N2��g��+CO2��g��+2H2O��g����H2=-1160kJ•mol-1��
��״����4.48LCH4���ʵ���=$\frac{4.48L}{22.4L/mol}$=0.2mol���Ȼ�ѧ����ʽ����õ�0.2mol���鷴Ӧ����=$\frac{1160KJ��0.2mol}{1mol}$=232KJ��
�ʴ�Ϊ��232��
��4��HNO3��As2S3�ܷ�����Ӧ��As2S3+10HNO3�T2H3AsO4+3S+10NO2��+2H2O����Ӧ��AsԪ�ػ��ϼ�+3�۱仯Ϊ+5�ۣ����ϼ����߱�������SԪ�ػ��ϼ�-2�۱仯Ϊ0�ۣ�Ԫ�ػ��ϼ����߱����������Ա�������Ԫ��ΪAs��S������ת���������ݷ���������ԭ��Ӧ���������õ�������10molNO2������ת��10��[��+5��-��+4��}=10mol������SΪ3mol�����÷�Ӧ��ת�Ƶĵ��ӵ����ʵ���Ϊ5molʱ������SΪ1.5mol�������ɵ�Sȫ��ת��ΪŨH2SO4���ʵ���Ϊ1.5mol��Cu+2H2SO4��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$CuSO4+SO2��+2H2O��������ȫ����Ӧ����ͭ0.75mol����Ũ���������ͭ��Ӧ�淴Ӧ���У�Ũ�ȼ�С����Ϊϡ���������ͭ����������Ӧ����������ͭ���ʵ���С��0.75mol��
�ʴ�Ϊ��a��
��5��pH=1�Ĵ����д����Ũ�ȴ���0.1mol/L����ͨ��0.1mol������Ӧ������ʣ�࣬��������������������笠����ӵĵ��룬笠�����Ũ�Ƚϴ��������������ǡ�÷�Ӧ��������Һ��笠�����Ũ�ȣ�c1=c2��c3����
�������Һ�����ԣ���һˮ�ϰ��ʹ���ĵ��볣����ͬ��������CH3COOH��Ka=1��10-5 mol•L-1������NH3•H2O�ĵ��볣��Ϊ1��10-5 mol•L-1��
Ka=$\frac{[N{{H}_{4}}^{+}][{H}^{+}]}{[N{H}_{3}��{H}_{2}O]}$=1��10-5��Kh=$\frac{Kh}{Ka}$=1��10-9��
��c��H+��Ϊxmol/L��
��Kh=$\frac{{x}^{2}}{0.1}$=1��10-9�����x=1��10-5mol/L������pH=5��
�ʴ�Ϊ��c1=c2��c3��5��
���� ���⿼����ۺϣ��漰ƽ�ⳣ�����㡢��Ӧ���ʼ��㡢ԭ��ص缫��Ӧ����д��������ʵĵ����֪ʶ�㣬��Щ���Ǹ߿���Ƶ�㣬���ؿ���ѧ�����������㼰֪ʶ�����������е��Ѷȣ�����ʱע�⻯ѧԭ��֪ʶ��������ã�

 �Ǽ�����������ϵ�д�
�Ǽ�����������ϵ�д� â���̸������Ծ�ϵ�д�
â���̸������Ծ�ϵ�д�| A�� | 2Fe2++4I-+3Cl2�T2Fe3++2I2+6Cl- | |
| B�� | 2Fe2++4I-+4Br-+5Cl2�T2Fe3++2I2+2Br2+10Cl- | |
| C�� | 2Fe2++2I-+2Br-+3Cl2�T2Fe3++I2+Br2+6Cl- | |
| D�� | 2Fe2++2I-+2Cl2�T2Fe3++I2+4Cl- |
| A�� | 64g/mol | B�� | 32g/mol | C�� | 16g | D�� | 8g |
| A�� | �ø�������̼��Ʒ�Ӧ��ȡ������̼��֤����Ԫ�طǽ����Դ���̼Ԫ�� | |
| B�� | ���ࡢ��֬����������һ�������¶��ܷ���ˮ�ⷴӦ | |
| C�� | �赥���ڵ��ӹ�ҵ��Ӧ�ù㷺���������ά | |
| D�� | ʯ�͵��ѻ��������塢ֲ�����Լ����������ʹ���Ը��������Һ��ɫ |
��ϡ��ʱ����Һ��c��OH-������
����Һ��pH��7��
����Һ��c��Na+��=c��A2-����
����Һ�������������ʵ���Ũ�ȵ�NaOH��Һǡ�÷�Ӧ��
| A�� | �٢ڢۢ� | B�� | �٢ۢ� | C�� | �٢� | D�� | �ڢ� |
| A�� | ���������������������һ����ͬ | |
| B�� | ���������������������һ����ͬ | |
| C�� | Y������CH4��O2��N2������֮�ȿ���Ϊ1��6��3 | |
| D�� | Y������CH4��O2��N2�����ʵ�����֮��һ��Ϊ1��3��6 |
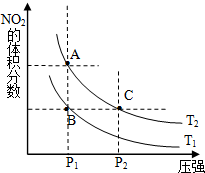 ��1���Է�ӦN2O4��g���T2NO2��g����H��0�����¶�ΪT1��T2ʱ��ƽ����ϵ��NO2�����������ѹǿ�仯������ͼ��ʾ��T1��T2�����������������=������A��C���������VA��VC��ͬ�ϣ���
��1���Է�ӦN2O4��g���T2NO2��g����H��0�����¶�ΪT1��T2ʱ��ƽ����ϵ��NO2�����������ѹǿ�仯������ͼ��ʾ��T1��T2�����������������=������A��C���������VA��VC��ͬ�ϣ�����2����100��ʱ����0.400mol��NO2�������2L��ն����ܱ������У�ÿ��һ��ʱ��ͶԸ������ڵ����ʽ��з������õ����±����ݣ�
| ʱ�䣨s�� | 0 | 20 | 40 | 60 | 80 |
| n��NO2��/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n��N2O4��/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
��������ͬ����������������������N2O4��Ҫ�ﵽ����ͬ����ƽ��״̬��N2O4����ʼŨ����0.1mol/L��
�ۼ�����������´ﵽƽ����������ƽ����Է�������Ϊ57.5�����������С�����һλ��
 ��
��