题目内容
7.将amolH2和Cl2的混合气体点燃,充分反应后用足量的NaOH溶液吸收,消耗了bmolNaOH.(1)填表
| H2和Cl2的物质的量关系 | n(H2)=n(Cl2) | n(H2)>n(Cl2) | n(H2)<n(Cl2) |
| 生成NaCl的物质的量 | amol(或bmol) | bmol | amol |
分析 氯气与氢气的反应为H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl,存在3种情况:①n(H2)=n(Cl2)时恰好反应,②n(H2)>n(Cl2)时氢气过量,③n(H2)<n(Cl2)时氯气过量,生成的HCl和过量的Cl2都与NaOH溶液反应,发生反应为:HCl+NaOH=NaCl+H2O、2NaOH+Cl2=NaCl+NaClO+H2O,
①n(H2)=n(Cl2)时恰好反应二者恰好反应生成HCl,HCl和NaOH溶液反应生成NaCl,根据反应HCl+NaOH=NaCl+H2O可知生成NaCl的物质的量为:n(NaCl)=2n(H2)=2n(Cl2)=n(NaOH);
②n(H2)>n(Cl2)时氢气过量,过量的氢气不与氢氧化钠溶液反应,根据反应H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl、HCl+NaOH=NaCl+H2O可知生成NaCl的物质的量为:n(NaCl)=n(NaOH);
③n(H2)<n(Cl2)时氯气过量,可设氢气的物质的量为xmol,则过量的氯气为(a-x-x)mol=(a-2x)mol,根据反应H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl、HCl+NaOH=NaCl+H2O可知生成NaCl的物质的量为2xmol,过量的氯气发生反应2NaOH+Cl2=NaCl+NaClO+H2O,则生成NaCl的物质的量为(a-2x)mol,所以生成NaCl的总物质的量为:2xmol+(a-2x)mol=amol,据此计算出生成氯化钠的物质的量,然后作出生成的NaCl与消耗的Cl2的关系的图象.
解答 解:(1)氯气与氢气的反应为:H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl,存在3种情况:①n(H2)=n(Cl2)时恰好反应,②n(H2)>n(Cl2)时氢气过量,③n(H2)<n(Cl2)时氯气过量,生成的HCl和过量的Cl2都与NaOH溶液反应,发生反应为:HCl+NaOH=NaCl+H2O、2NaOH+Cl2=NaCl+NaClO+H2O,
①n(H2)=n(Cl2)时恰好反应二者恰好反应生成HCl,HCl和NaOH溶液反应生成NaCl,根据反应HCl+NaOH=NaCl+H2O可知生成NaCl的物质的量为:n(NaCl)=2n(H2)=2n(Cl2)=n(NaOH)=bmol或$\frac{a}{2}$mol×2=amol;
②n(H2)>n(Cl2)时氢气过量,过量的氢气不与氢氧化钠溶液反应,根据反应H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl、HCl+NaOH=NaCl+H2O可知生成NaCl的物质的量为:n(NaCl)=n(NaOH)=bmol;
③n(H2)<n(Cl2)时氯气过量,可设氢气的物质的量为xmol,则过量的氯气为(a-x-x)mol=(a-2x)mol,根据反应H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl、HCl+NaOH=NaCl+H2O可知生成NaCl的物质的量为2xmol,
过量的氯气发生反应2NaOH+Cl2=NaCl+NaClO+H2O,则生成NaCl的物质的量为(a-2x)mol,
所以生成NaCl的总物质的量为:2xmol+(a-2x)mol=amol,
故答案为:
| H2和Cl2的物质的量关系 | n(H2)=n(Cl2) | n(H2)>n(Cl2) | n(H2)<n(Cl2) |
| 生成NaCl的物质的量 | amol(或bmol) | bmol | amol |
②n(H2)>n(Cl2)时氢气过量,过量的氢气不与氢氧化钠溶液反应,根据反应H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl、HCl+NaOH=NaCl+H2O可知生成NaCl的物质的量为:n(NaCl)=n(NaOH)=amol;
③n(H2)<n(Cl2)时氯气过量,生成氯化钠的物质的量为amol,则n(Cl2)为横坐标,n(NaCl)为纵坐标,作出生成的NaCl与消耗的Cl2的关系图为:
 ,
,答:以n(Cl2)为横坐标,n(NaCl)为纵坐标,生成的NaCl与消耗的Cl2的关系图为
 .
.点评 本题考查了化学方程式的计算,题目难度中等,根据反应物过量情况正确判断反应产物为解答关键,注意掌握讨论法在化学计算中的应用,试题培养了学生的分析能力及化学计算能力.

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案| A. | SO2 | B. | Ca(ClO)2 | C. | NaClO | D. | H2SO4(浓) |
| A. | 1.1 mol•l-1 | B. | 1.5mol•L-1 | C. | 2.4 mol•L-1 | D. | 无法确定 |
| A. | NaHSO4溶液与NaOH溶液混合 | B. | NH4Cl溶液与Ca(OH)2溶液混合 | ||
| C. | HNO3溶液与石灰乳混合 | D. | Na2HPO4溶液与NaOH溶液混合 |
| A. | 加三聚氰胺提高牛奶的含氮量 | |
| B. | 用苏丹红(色素)作食品着色剂 | |
| C. | 加小苏打(NaHCO3)作馒头的膨松剂 | |
| D. | 用含有甲醇(CH3OH)的工业酒精兑制饮用白酒 |
| A. | 升高温度 | B. | 增加压强 | C. | 增大反应物的量 | D. | 使用催化剂 |
 (2)
(2)
 (4)
(4)
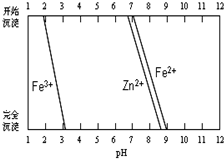 铁酸锌(ZnFe2O4)是对可见光敏感的半导体催化剂,其实验室制备原理为:
铁酸锌(ZnFe2O4)是对可见光敏感的半导体催化剂,其实验室制备原理为: