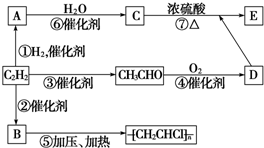
题目内容
已知α-氨基酸在一定条件下能与亚硝酸HNO2反应得到α-羟基酸.如: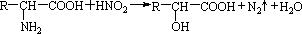
试根据如图所示关系回答有关问题:
(1)写出A、B结构简式:A ; B .
(2)写出C→E的化学方程式: .
(3)写出C→D的化学方程式: .
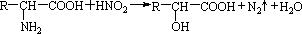
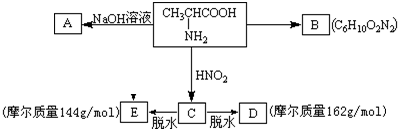
试根据如图所示关系回答有关问题:

(1)写出A、B结构简式:A
(2)写出C→E的化学方程式:
(3)写出C→D的化学方程式:
考点:有机物的推断
专题:有机物的化学性质及推断
分析:氨基酸能发生缩聚反应,脱去一个H2O分子,即-COOH脱去-OH,-NH2脱去-H,发生缩聚反应生成蛋白质,由此结合B的分子式可推知,2个丙氨酸分子间脱去2个H2O分子生成环状B为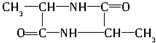 .丙氨酸与氢氧化钠发生中和反应生成A为
.丙氨酸与氢氧化钠发生中和反应生成A为 .由题目中所给信息可总结出:在HNO2作用下,氨基酸中的-NH2可转变成-OH,可得C为
.由题目中所给信息可总结出:在HNO2作用下,氨基酸中的-NH2可转变成-OH,可得C为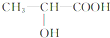 ,其摩尔质量为90g/mol.由于C中含有-COOH和-OH,发生脱水反应生成D与E,由D的摩尔质量为162g/mol,即由2分子C脱去1分子水生成,则D的结构简式为
,其摩尔质量为90g/mol.由于C中含有-COOH和-OH,发生脱水反应生成D与E,由D的摩尔质量为162g/mol,即由2分子C脱去1分子水生成,则D的结构简式为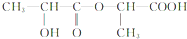 ;E的摩尔质量为144g/mol,即2分子C脱去2分子水生成环状产物E,故E的结构简式为
;E的摩尔质量为144g/mol,即2分子C脱去2分子水生成环状产物E,故E的结构简式为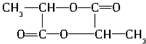 ,据此解答.
,据此解答.
 .丙氨酸与氢氧化钠发生中和反应生成A为
.丙氨酸与氢氧化钠发生中和反应生成A为 .由题目中所给信息可总结出:在HNO2作用下,氨基酸中的-NH2可转变成-OH,可得C为
.由题目中所给信息可总结出:在HNO2作用下,氨基酸中的-NH2可转变成-OH,可得C为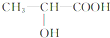 ,其摩尔质量为90g/mol.由于C中含有-COOH和-OH,发生脱水反应生成D与E,由D的摩尔质量为162g/mol,即由2分子C脱去1分子水生成,则D的结构简式为
,其摩尔质量为90g/mol.由于C中含有-COOH和-OH,发生脱水反应生成D与E,由D的摩尔质量为162g/mol,即由2分子C脱去1分子水生成,则D的结构简式为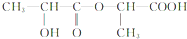 ;E的摩尔质量为144g/mol,即2分子C脱去2分子水生成环状产物E,故E的结构简式为
;E的摩尔质量为144g/mol,即2分子C脱去2分子水生成环状产物E,故E的结构简式为 ,据此解答.
,据此解答.解答:
解:氨基酸能发生缩聚反应,脱去一个H2O分子,即-COOH脱去-OH,-NH2脱去-H,发生缩聚反应生成蛋白质,由此结合B的分子式可推知,2个丙氨酸分子间脱去2个H2O分子生成环状B为 .丙氨酸与氢氧化钠发生中和反应生成A为
.丙氨酸与氢氧化钠发生中和反应生成A为 .由题目中所给信息可总结出:在HNO2作用下,氨基酸中的-NH2可转变成-OH,可得C为
.由题目中所给信息可总结出:在HNO2作用下,氨基酸中的-NH2可转变成-OH,可得C为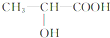 ,其摩尔质量为90g/mol.由于C中含有-COOH和-OH,发生脱水反应生成D与E,由D的摩尔质量为162g/mol,即由2分子C脱去1分子水生成,则D的结构简式为
,其摩尔质量为90g/mol.由于C中含有-COOH和-OH,发生脱水反应生成D与E,由D的摩尔质量为162g/mol,即由2分子C脱去1分子水生成,则D的结构简式为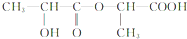 ;E的摩尔质量为144g/mol,即2分子C脱去2分子水生成环状产物E,故E的结构简式为
;E的摩尔质量为144g/mol,即2分子C脱去2分子水生成环状产物E,故E的结构简式为 ,
,
(1)根据以上分析,A、B结构简式分别为: 、
、 ,
,
故答案为: ;
; ;
;
(2)根据以上分析,2分子C脱去2分子水生成环状产物E,则C→E的化学方程式:2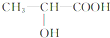
 +2H2O,
+2H2O,
故答案为:2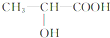
 +2H2O;
+2H2O;
(3)根据以上分析,2分子C脱去1分子水生成D,则C→D的化学方程式为 ,
,
故答案为: .
.
 .丙氨酸与氢氧化钠发生中和反应生成A为
.丙氨酸与氢氧化钠发生中和反应生成A为 .由题目中所给信息可总结出:在HNO2作用下,氨基酸中的-NH2可转变成-OH,可得C为
.由题目中所给信息可总结出:在HNO2作用下,氨基酸中的-NH2可转变成-OH,可得C为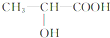 ,其摩尔质量为90g/mol.由于C中含有-COOH和-OH,发生脱水反应生成D与E,由D的摩尔质量为162g/mol,即由2分子C脱去1分子水生成,则D的结构简式为
,其摩尔质量为90g/mol.由于C中含有-COOH和-OH,发生脱水反应生成D与E,由D的摩尔质量为162g/mol,即由2分子C脱去1分子水生成,则D的结构简式为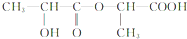 ;E的摩尔质量为144g/mol,即2分子C脱去2分子水生成环状产物E,故E的结构简式为
;E的摩尔质量为144g/mol,即2分子C脱去2分子水生成环状产物E,故E的结构简式为 ,
,(1)根据以上分析,A、B结构简式分别为:
 、
、 ,
,故答案为:
 ;
; ;
;(2)根据以上分析,2分子C脱去2分子水生成环状产物E,则C→E的化学方程式:2
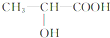
| 浓硫酸 |
| △ |
 +2H2O,
+2H2O,故答案为:2
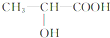
| 浓硫酸 |
| △ |
 +2H2O;
+2H2O;(3)根据以上分析,2分子C脱去1分子水生成D,则C→D的化学方程式为
 ,
,故答案为:
 .
.
点评:本题考查有机物推断以及常见物质的化学性质的应用,涉及氨基酸、醇、羧酸性质与转化,注意根据摩尔质量与对给予的信息进行推断,难度中等.

练习册系列答案
相关题目
11.6gFe3O4加到100mL某浓度的盐酸中,再加入9.8g铁粉,反应停止时,溶液中无固体存在.向溶液中滴加氰化钾溶液,未见颜色变化,为了中和过量的盐酸(不考虑盐酸的挥发),且使铁完全转化为Fe(OH)2,共消耗5.0mol?L-1NaOH溶液160mL,原盐酸的物质的量浓度为( )
| A、2mol?L-1 |
| B、4mol?L-1 |
| C、6mol?L-1 |
| D、8mol?L-1 |
除去苯中所含的苯酚,可采用的适宜方法是( )
| A、加70℃以上的热水,分液 |
| B、加足量NaOH溶液,分液 |
| C、加适量浓溴水,过滤 |
| D、加适量FeCl3溶液,过滤 |
下列各组比较中,前者大于后者的是( )
| A、中和体积与pH都相等的醋酸溶液和盐酸所消耗的NaOH的质量 |
| B、软水和硬水中Ca2+、Mg2+的含量 |
| C、硫酸工业中二氧化硫的催化氧化反应与合成氨生产中所采用的压强 |
| D、相同温度、相同浓度的NH4Cl和NH4HSO4溶液中c(NH4+) |
实验室为标定一种烧碱样品的物质的量浓度,称取该烧碱样品4.0g配成1L溶液,取出20.00mL置于锥形瓶中,以甲基橙为指示剂,用0.10mol?L-1 HCl标准溶液滴定,恰好完全中和时消耗标准盐酸19.00mL,若烧碱中只含有一种杂质,则不可能是( )
| A、NaCl |
| B、Ca(OH)2 |
| C、Na2 CO3 |
| D、NaHCO3 |
氢氧燃料电池的电解质溶液常见有硫酸和氢氧化钾两种,下列有关叙述正确的是( )
| A、此电池能发出蓝色的火焰 |
| B、氧气为正极,氢气为负极 |
| C、工作时电解液一定与H2反应 |
| D、负极:2H2+4OH--4e-═4H2O |