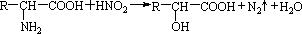题目内容
11.6gFe3O4加到100mL某浓度的盐酸中,再加入9.8g铁粉,反应停止时,溶液中无固体存在.向溶液中滴加氰化钾溶液,未见颜色变化,为了中和过量的盐酸(不考虑盐酸的挥发),且使铁完全转化为Fe(OH)2,共消耗5.0mol?L-1NaOH溶液160mL,原盐酸的物质的量浓度为( )
| A、2mol?L-1 |
| B、4mol?L-1 |
| C、6mol?L-1 |
| D、8mol?L-1 |
考点:化学方程式的有关计算
专题:计算题
分析:该过程中发生的反应为:Fe3O4+8HCl=2FeCl3+FeCl2+4H2O、Fe+2HCl=FeCl2+H2↑、2FeCl3+Fe=3FeCl2、FeCl2+2NaOH=Fe(OH)2↓+2NaCl、NaOH+HCl=NaCl+H2O,最终溶液中的溶质是NaCl,根据原子守恒计算盐酸的浓度.
解答:
解:该过程中发生的反应为:Fe3O4+8HCl=2FeCl3+FeCl2+4H2O、Fe+2HCl=FeCl2+H2↑、2FeCl3+Fe=3FeCl2、FeCl2+2NaOH=Fe(OH)2↓+2NaCl、NaOH+HCl=NaCl+H2O,最终溶液中的溶质是NaCl,原子守恒得n(NaOH)=n(NaCl)=n(HCl),则c(HCl)=
=
=8 mol?L-1,
故选D.
| n(NaOH) |
| V(HCl) |
| 5mol/L×0.16L |
| 0.1L |
故选D.
点评:本题考查了方程式的计算,明确最终溶液中的溶质是解此题关键,再结合原子守恒解答即可,题目难度中等.

练习册系列答案
相关题目
下列实验方法正确的是( )
| A、从溴水中提取溴可用酒精作为萃取剂 |
| B、检验碘化钾溶液可用淀粉 |
| C、分离碘和食盐可用加热的方法 |
| D、用加热的方法除去铜中混有的氧化铜 |
下列关于难溶电解质的溶解平衡描述中正确的是( )
| A、沉淀溶解达到平衡时,溶液中各离子的浓度一定相等 |
| B、沉淀溶解达到平衡时,如果再加入难溶性的该沉淀物,将促进溶解 |
| C、难溶电解质的溶解平衡是一种动态平衡,可以通过改变条件使平衡移动 |
| D、沉淀转化的实质就是沉淀溶解平衡的移动,一般说来,溶解度小的沉淀转化成溶解度大的沉淀更容易实现 |
将16gFeS与FeO的混合物,投入到1L1mol/L的硝酸溶液中充分反应,只产生
molNO气体,得到澄清的混合溶液.下列计算结果正确的是 ( )
| 1 |
| 3 |
| A、混合物中含有0.5molFeS |
| B、混合物中含有0.1mol FeO |
| C、参加反应的HNO3为1mol |
| D、氧化产物Fe3+为0.15mol |
下表是3种物质的溶解度(20℃),下列说法中正确的是( )
| 物质 | MgCl2 | Mg(OH)2 | MgCO3 |
| 溶解度(g) | 74 | 0.0009 | 0.02 |
| A、已知MgCO3的Ksp=6.8×10-6(mol?L-1)2,则所有含固体MgCO3的溶液中,都有c(Mg2+)=c(CO32-),且c(Mg2+)?c(CO32-)=6.8×10-6 (mol?L-1)2 |
| B、将MgCl2与水混合,再对溶液蒸干、灼烧,最终所得固体产物为MgO |
| C、除去粗盐中含有的MgCl2杂质,最佳除杂试剂为Na2CO3溶液 |
| D、用石灰水处理含有Mg2+和HCO3-的硬水,发生的离子反应方程式为:Mg2++2HCO3-+Ca2++2OH-═CaCO3↓+MgCO3↓+2H2O |