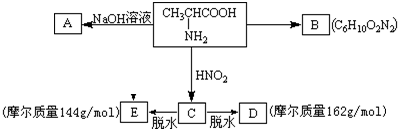
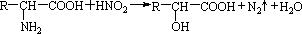题目内容
实验室为标定一种烧碱样品的物质的量浓度,称取该烧碱样品4.0g配成1L溶液,取出20.00mL置于锥形瓶中,以甲基橙为指示剂,用0.10mol?L-1 HCl标准溶液滴定,恰好完全中和时消耗标准盐酸19.00mL,若烧碱中只含有一种杂质,则不可能是( )
| A、NaCl |
| B、Ca(OH)2 |
| C、Na2 CO3 |
| D、NaHCO3 |
考点:有关混合物反应的计算
专题:
分析:先根据n=cV计算出20mL样品溶液消耗的氯化氢的物质的量,再计算出1L样品溶液消耗的氯化氢的物质的量,再根据反应方程式计算出含有氢氧化钠的物质的量、质量,根据计算结果判断杂质消耗的氯化氢比氢氧化钠多还是少,然后对各选项进行判断即可.
解答:
解:19,00mL 0.1000mol?L-1 HCl标准液中含有HCl的物质的量为:0.1mol/L×0.019mol=0.0019mol,
根据反应方程式:HCl+NaOH=NaCl+H2O可知,20.00mL配制的溶液中含有0.0019molNaOH,则1L该溶液中含有氢氧化钠的物质的量为:0.0019mol×
=0.095mol,溶液中含有氢氧化钠的质量为:40g/mol×0.095mol=3.8g<4.0g,
说明含有的杂质在等质量时消耗HCl的物质的量小于NaOH,已知40g氢氧化钠消耗1molHCl,
A.氯化钠不与氯化氢反应,含有氯化钠时消耗的氯化氢减少,满足条件,故A不选;
B.74g氢氧化钙消耗2molHCl,37g氢氧化钙消耗1molHCl,等质量时消耗的HCl大于氢氧化钠,不满足条件,故B选;
C.106g Na2CO3消耗2molHCl,53g Na2CO3消耗1mol氯化氢,等质量时消耗的氯化氢需要氢氧化钠,满足条件,故C不选;
D.84g NaHCO3消耗1mol盐酸,等质量时消耗的氯化氢需要氢氧化钠,满足条件,故D不选;
故选B.
根据反应方程式:HCl+NaOH=NaCl+H2O可知,20.00mL配制的溶液中含有0.0019molNaOH,则1L该溶液中含有氢氧化钠的物质的量为:0.0019mol×
| 1000mL |
| 20mL |
说明含有的杂质在等质量时消耗HCl的物质的量小于NaOH,已知40g氢氧化钠消耗1molHCl,
A.氯化钠不与氯化氢反应,含有氯化钠时消耗的氯化氢减少,满足条件,故A不选;
B.74g氢氧化钙消耗2molHCl,37g氢氧化钙消耗1molHCl,等质量时消耗的HCl大于氢氧化钠,不满足条件,故B选;
C.106g Na2CO3消耗2molHCl,53g Na2CO3消耗1mol氯化氢,等质量时消耗的氯化氢需要氢氧化钠,满足条件,故C不选;
D.84g NaHCO3消耗1mol盐酸,等质量时消耗的氯化氢需要氢氧化钠,满足条件,故D不选;
故选B.
点评:本题考查了有关讨论的化学计算,题目难度中等,根据题干信息得出杂质对消耗氯化氢的量的影响为解答关键,注意掌握有关混合物计算的方法,试题有利于培养学生的分析、理解能力及化学计算能力.

练习册系列答案
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案
相关题目
下列说法正确的是( )
| A、煤是复杂的混合物,含有苯、甲苯、二甲苯等一系列重要的化工原料 |
| B、石油分馏得到的汽油、煤油、柴油等都有固定的熔沸点 |
| C、石油炼制的目的是为了获得轻质油和重要化工原料(乙烯、丙烯等) |
| D、电解冶炼铝的原料是氯化铝 |
下表是3种物质的溶解度(20℃),下列说法中正确的是( )
| 物质 | MgCl2 | Mg(OH)2 | MgCO3 |
| 溶解度(g) | 74 | 0.0009 | 0.02 |
| A、已知MgCO3的Ksp=6.8×10-6(mol?L-1)2,则所有含固体MgCO3的溶液中,都有c(Mg2+)=c(CO32-),且c(Mg2+)?c(CO32-)=6.8×10-6 (mol?L-1)2 |
| B、将MgCl2与水混合,再对溶液蒸干、灼烧,最终所得固体产物为MgO |
| C、除去粗盐中含有的MgCl2杂质,最佳除杂试剂为Na2CO3溶液 |
| D、用石灰水处理含有Mg2+和HCO3-的硬水,发生的离子反应方程式为:Mg2++2HCO3-+Ca2++2OH-═CaCO3↓+MgCO3↓+2H2O |
常温下,下列溶液中各离子浓度关系正确的是( )
| A、等物质的量的氨水和盐酸混合后的溶液:c(H+)=c(OH-)+c(NH3?H2O) |
| B、浓度为0.1 mol?L-1的碳酸钠溶液:c(Na+)=2c(CO32-)+c(HCO3-)+c(H2CO3) |
| C、将pH=3的盐酸溶液和pH=11的氨水等体积混合:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| D、醋酸溶液与NaOH溶液相混合后,所得溶液呈中性:c(Na+)>c(CH3COO-) |
下列微粒对CH3COO-+H2O?CH3COOH+OH- 水解平衡有影响的是( )
| A、H3O+ |
B、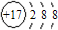 |
| C、NO3- |
| D、Ba2+ |