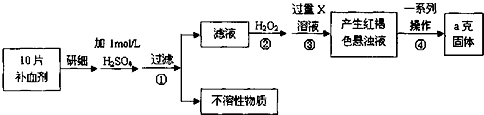
题目内容
A、B、C、D、E是原子序数依次增大的五种短周期元素.A原子的电子层数与它的核外电子总数相同,A与C、B与D分别为同主族,B和C的最外层电子数之和与E的最外层电子数相同.A与E形成的化合物化学式为AE,其分子中含18个电子.请回答下列问题:
(1)由A、B、C三种元素形成的化合物的电子式为 ,这种化合物中所含的化学键类型有 .
(2)A2B的沸点高于A2D,其原因是 .
(3)B、C、E三种元素形成一种盐,此盐中三种原子个数比为1?1?1,在25℃时,将该盐溶于水,测得溶液pH>7,理由是 (用离子方程式表示);将该盐溶液在空气中露置一段时间后(充分光照,不考虑水分的挥发),溶液的pH近似为7,则该过程的总反应方程式为 .
(1)由A、B、C三种元素形成的化合物的电子式为
(2)A2B的沸点高于A2D,其原因是
(3)B、C、E三种元素形成一种盐,此盐中三种原子个数比为1?1?1,在25℃时,将该盐溶于水,测得溶液pH>7,理由是
考点:位置结构性质的相互关系应用,化学键
专题:元素周期律与元素周期表专题,化学键与晶体结构
分析:A、B、C、D、E是原子序数依次增大的五种短周期元素,A原子的电子层数与它的核外电子总数相同,则A为氢元素;A与E形成的化合物化学式为AE,其分子中含18个电子,故E为氯元素;A与C同主族,处于ⅠA族,B和C的最外层电子数之和与E的最外层电子数相同,则B的最外层电子数为7-1=6,处于ⅥA族,B与D为同主族,原子序数B小于D,则B为氧元素,D为硫元素;C原子序数大于氧元素,C与氢元素为同主族,故C为钠元素,据此解答.
(1)A为H,B为O,C为Na,由A、B、C三种元素形成的化合物为NaOH,含有离子键、共价键;
(2)氢键影响晶体的熔沸点,H2O分子之间存在氢键,其沸点高于H2S;
(3)B为O,C为Na,E为Cl;形成一种盐,测得溶液pH>7,为强碱弱酸盐,为NaClO,据此分析解答;
(1)A为H,B为O,C为Na,由A、B、C三种元素形成的化合物为NaOH,含有离子键、共价键;
(2)氢键影响晶体的熔沸点,H2O分子之间存在氢键,其沸点高于H2S;
(3)B为O,C为Na,E为Cl;形成一种盐,测得溶液pH>7,为强碱弱酸盐,为NaClO,据此分析解答;
解答:
解:A、B、C、D、E是原子序数依次增大的五种短周期元素,A原子的电子层数与它的核外电子总数相同,则A为氢元素;A与E形成的化合物化学式为AE,其分子中含18个电子,故E为氯元素;A与C同主族,处于ⅠA族,B和C的最外层电子数之和与E的最外层电子数相同,则B的最外层电子数为7-1=6,处于ⅥA族,B与D为同主族,原子序数B小于D,则B为氧元素,D为硫元素;C原子序数大于氧元素,C与氢元素为同主族,故C为钠元素,
(1)由A、B、C三种元素形成的化合物为NaOH,氢氧化钠是离子化合物,由钠离子与氢氧根离子构成,电子式为 .晶体中钠离子与氢氧根离子之间形成离子键,氢氧根离子中氢原子与氧原子之间形成共价键,
.晶体中钠离子与氢氧根离子之间形成离子键,氢氧根离子中氢原子与氧原子之间形成共价键,
故答案为: ;离子键、共价键;
;离子键、共价键;
(2)H2O分子间存在氢键而H2S分子间不存在氢键,故H2O的沸点比H2S高,
故答案为:H2O分子之间存在氢键;
(3)B、C、E三种元素形成一种盐,此盐中三种原子个数比为1:1:1,该盐为NaClO,次氯酸钠属于强碱弱酸盐,在溶液中ClO-发生水解:ClO-+H2O?HClO+OH-,使溶液呈碱性,溶液pH>7;
将该盐溶液在空气中露置一段时间后(充分光照,不考虑水分的挥发),HClO分解为HCl与氧气,HCl与氢氧化钠反应生成NaCl,故最终溶液几乎为NaCl溶液,溶液的pH近似为7,则该过程的总反应方程式为2NaClO=2NaCl+O2↑,
故答案为:ClO-+H2O?HClO+OH-;2NaClO=2NaCl+O2↑;
(1)由A、B、C三种元素形成的化合物为NaOH,氢氧化钠是离子化合物,由钠离子与氢氧根离子构成,电子式为
 .晶体中钠离子与氢氧根离子之间形成离子键,氢氧根离子中氢原子与氧原子之间形成共价键,
.晶体中钠离子与氢氧根离子之间形成离子键,氢氧根离子中氢原子与氧原子之间形成共价键,故答案为:
 ;离子键、共价键;
;离子键、共价键;(2)H2O分子间存在氢键而H2S分子间不存在氢键,故H2O的沸点比H2S高,
故答案为:H2O分子之间存在氢键;
(3)B、C、E三种元素形成一种盐,此盐中三种原子个数比为1:1:1,该盐为NaClO,次氯酸钠属于强碱弱酸盐,在溶液中ClO-发生水解:ClO-+H2O?HClO+OH-,使溶液呈碱性,溶液pH>7;
将该盐溶液在空气中露置一段时间后(充分光照,不考虑水分的挥发),HClO分解为HCl与氧气,HCl与氢氧化钠反应生成NaCl,故最终溶液几乎为NaCl溶液,溶液的pH近似为7,则该过程的总反应方程式为2NaClO=2NaCl+O2↑,
故答案为:ClO-+H2O?HClO+OH-;2NaClO=2NaCl+O2↑;
点评:本题考查结构性质位置关系应用,涉及元素推断及元素化合物性质、常用化学用语、盐类水解等,推断元素是解题关键,题目难度中等.

练习册系列答案
相关题目
下列氢化物的性质按顺序排列正确的是( )
| A、HI、HBr、HCl、HF(酸性减弱) |
| B、HCl、H2S、PH3、SiH4(稳定性减弱) |
| C、H2O、H2S、HCl、HBr(还原性增强) |
| D、HF、H2O、PH3、NH3 (稳定性减弱) |
下列实验操作正确的是( )
| A、过滤时,漏斗的下端应紧贴烧杯内壁 |
| B、给试管中的液体加热时,可以用手直接拿试管 |
| C、给试管中的固体加热时,试管口应略向上倾斜 |
| D、蒸馏液体时,冷水应从冷凝管的上端进入,下端出 |
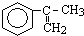 出发来合成A,其合成路线如下:
出发来合成A,其合成路线如下: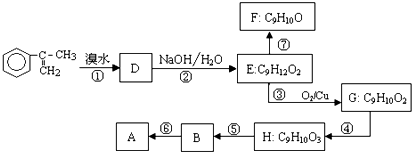
 某同学设计实验探究构成原电池的条件,装置如下:
某同学设计实验探究构成原电池的条件,装置如下: